Cancerul ereditar de sân și ovar (HBOC) și testarea mutațiilor în genele BRCA1 și BRCA2
Genele BRCA1 sau BRCA2 (BReast Cancer Associated) – Prezentare generală
De asemenea, este cunoscută implicarea genelor BRCA1/2 în predispoziția pentru alte tipuri de cancere (de prostată, pancreatic, uterin, cervical, gastric, vezical, de duct biliar sau melanoame).
Această predispoziție se identifică prin testarea genetică pentru mutații în genele BRCA1/2 iar pacienții identificați cu mutații patogene beneficiază de screening și metode de prevenție menite să reducă riscul de a dezvolta HBOC.
Genele BRCA1 și BRCA2 și rolul lor
Genele BRCA1 (cu localizare pe brațul lung al cromozomului 17 – 17q21) și BRCA2 (localizare citogenetică pe brațul lung al cromozomului 13 – 13q12.3) sunt gene cu rol de supresor al creșterii tumorale, fiind implicate în repararea rupturilor de la nivelul ADN dublu catenar, controlul ciclului celular și menținerea stabilității genomice.
Ambele gene sintetizează proteine (BRCA1, respectiv BRCA2) care participă la formarea unor complexe multiproteice cu diferite alte proteine adaptoare pentru efectuarea funcțiilor specifice. Un astfel de complex proteic este complexul BASC (BRCA1 Associated genome Surveillance), care conține un număr de proteine care sunt implicate în repararea eficientă a leziunilor ADN.
Mutații la nivelul acestor gene determină alterarea sau incapacitatea efectuării acestor funcții și predispoziție crescută pentru tipurile de cancer mai sus prezentate.
BRCA1 și 2 sunt gene esențiale pentru dezvoltarea celulară. În absența unor gene BRCA funcționale, celulele sunt ineficiente în repararea leziunilor ADN prin recombinare omoloagă, ducând la apoptoza sau la transformarea malignă a acestora.
Persoanele cu mutații patogene în BRCA1/BRCA2 au un risc mai mare decât cel din populația generală de a dezvolta la un moment dat în viață un astfel de cancer (risc estimat până la 70 de ani):
| Tipul de cancer | Riscul în populația generală | Riscul mutațional BRCA 1 | Riscul mutațional BRCA 2 |
|---|---|---|---|
| Cancer de sân | 12% | 50%-80% | 40%-70% |
| Al doilea cancer primar de sân | 3,5% în primii 5 ani >11% | 27% în primii 5 ani | 12% în primii 5 ani 40%-50% la 20 de ani |
| Cancer ovarian | 1%-2% | 24%-40% | 11%-18% |
| Cancer de sân la bărbat | 0,1% | 1%-2% | 5%-10% |
| Cancer de prostată | 15%-18% | <30% | <39% |
| Cancer pancreatic | 0,5% | 1%-3% | 2%-7% |
Prevalența mutațiilor BRCA1/2
HBOC apare în toate grupurile etnice și în toate tipurile de populație.
Prevalența mutațiilor patogene BRCA1/2 în populația generală (frecvența purtătorilor) este 1/400 (excluzând evreii Ashkenazi, unde există o frecvență mai crescută).
Diagnosticul de HBOC se face prin testarea genetică pentru mutații în genele BRCA1/BRCA2.
Diagnostic diferențial
Uneori testarea genetică este necesară pentru efectuarea unui diagnostic diferențial deoarece nu întotdeauna un cancer de sân sindromic poate fi distins de un cancer de sân din cadrul unui HBOC doar pe baza tabloului clinic ( constelația de tumori prezentă într-o familie). Următoarele sindroame care se caracterizează prin predispoziție pentru multiple tipuri de cancere printre care și cancer de sân trebuiesc diferențiate de HBOC:
Utilitatea testării
Importanța testării rezidă în faptul că managementul unui pacient cu cancer de sân/ovar care prezintă mutații patogene în genele BRCA1/BRCA2 se va modifica foarte mult comparativ cu cel practicat în cazul formelor sporadice.
- Tratamentul va include molecule ce acționează specific la nivelul căilor de semnalizare celulară implicate în activitatea genelor BRCA
- Prevenția va include posibilitatea practicării mastectomiei profilactice sau ovarectomiei profilactice precum și a chemoprofilaxiei cu tamoxifen
- Monitorizarea se modifică astfel:
| – autoexaminare lunară a sânilor- examinare clinică anuală/semianuală a sânilor; – mamografie anuală; – RMN sâni anual; – tuseu rectal anual; – test PSA anual; – examen dermatologic și oftalmologic anual (risc crescut de melanom în cazul mutațiilor patogene în BRCA2). |
- Evaluarea riscului relativ în cazul celorlalți membri ai familiei aflați la risc.Dacă persoana testată prezintă o mutație germinală patogenă în BRCA1/BRCA2, ceilalți membri ai familiei aflați cu risc crescut pot fi testați pentru a se verifica statusul de purtător al respectivei mutații patogene. De asemenea, managementul purtătorilor va fi modificat în sensul că monitorizarea va fi mai atentă și va exista posibilitatea unei intervenții precoce dacă la un moment dat vor dezvolta HBOC.
- Consilierea genetică.
| Mutațiile patogene BRCA1/ BRCA2 se transmit după un model autozomal dominant deci fiecare descendent al unui purtător de astlfe de mutație are 50% să moștenească mutația. |
Dacă mutația este deja cunoscută la nivel familial, există posibilitatea diagnosticului prenatal în cazul unei sarcini dar acesta se practică rar și sfatul genetic va trebui acordat cu foarte mare grijă în acest caz.
Deși ne-am aștepta ca fiecare purtător de mutație să aibă la rândul său un părinte afectat de o formă de cancer sau măcar purtător, acest lucru nu va fi o regulă în practică datorită următorilor factori:
- penetranța incompletă
- vârsta variabilă de apariție a cancerului
- practicarea chirurgiei profilactice pentru reducerea riscului
- decesul precoce
Selecția pacienților și indicații de testare
Diagnosticul de HBOC se face prin testarea genetică pentru mutații în genele BRCA1/BRCA2. Selecția pacienților care pot fi testați se face pe baza suspiciunii unei probabilități crescute de a identifica o mutație patogenă în funcție de istoricul personal și familial caracteristic și de unele criterii clinice bine stabilite.
Teste disponibile în laboratoarele Synevo:
Selecția pacienților
Investigarea riscului genetic (urmată de testarea pentru mutațiile BRCA) este un proces în mai multi pași care implică identificarea persoanelor cu risc crescut de a fi purtătoare de mutații patogene apoi consilierea genetică a acestora de către medicul genetician și în final testarea genetică a persoanelor identificate a avea risc crescut.
Există urmatoarele situații în care o persoană poate beneficia de testare:
- Persoanele fără istoric personal de cancer de sân/ovar dar care au o rudă afectată care poate fi testată. În acest caz testarea se va face mai întâi rudei afectate.
- Persoanele fără istoric personal de cancer de sân/ovar și care nu au o rudă afectată care să poată fi testată dar care solicită la cerere testarea genetică. În acest caz testarea genetică se va face direct solicitantului.
- Persoanele care au deja cancer sân/ovar pentru selecția celor BRCA1/2 pozitivi.
Indicații de testare BRCA1/2
Estimarea probabilității crescute de a fi purtător de mutație se va face pe baza criteriilor de mai sus și a istoricului personal sau familial (rude de gradul I,II sau III în aceeași linie parentală – maternă sau paternă) pentru oricare din următoarele caracteristici (conform ESMO – European Society of Medical Oncology, 2015 și ASCO – American Society of Clinical Oncology, 2015):
Metoda
Analiza se efectuează din sânge venos prelevat pe EDTA în cantitate de 6-10 ml. Stabilitatea probei stocate este de 7 zile (refrigerată) și nu mai mult de 3 zile ( la temperatura camerei).
Pacienții transfuzați pot fi analizați la 2 săptămâni de la o transfuzie cu masă eritrocitară și la cel puțin 4 săptămâni după o transfuzie cu sânge integral.
Pentru pacienții care fac chimioterapie poate fi necesară o probă suplimentară dacă au făcut tratament în ultimele 120 de zile.
ADN-ul extras va fi secvențiat prin tehnica de secvențiere masivă paralelă de ultimă generație (NGS – Next Generation Sequencing) pentru regiunile codante ale genelor BRCA1 și BRCA2.
Inițial se amplifică prin tehnica PCR (Polymerase Chain Reaction), toate regiunile codante ale genelor BRCA utilizând un mix de primeri. Ampliconii rezultați în urma reacției PCR vor fi marcați și biblioteca de ampliconi astfel creată va fi secvențiată. Secvențele astfel rezultate vor fi comparate cu secvența de referință a genelor BRCA (Human Gene Mutation Database) pentru identificarea poziției variantelor identificate prin testare.
Rezultate și interpretare
Analiza va identifica mai multe mutații a căror semnificație clinică va fi interpretată de către medicul genetician deoarece nu toate variantele detectate (mutații) sunt automat patogene. De asemenea, va furniza informații despre exonul în care se găsește varianta, poziția la nivel cromozomial, tipul de mutație (deleție/inserție/duplicație/SNV – Single Nucleotide Variant).
Interpretarea acestor rezultate este însă un proces complex care se bazează pe:
- rezultatele analizei de secvențiere
- datele furnizate de literatura de specialitate
- datele furnizate de bazele de date recunoscute
- datele furnizate de baza proprie de date (“in house”)
- statusul clinic și istoricul personal și familial al pacientului
- experiența medicului genetician
Rezultatul testului se raportează sub forma:
- pozitiv – semnifică identificarea de mutații patogene sau cu potențial patogen. Identificarea unor astfel de variante este sinonimă cu riscul crescut de a dezvolta HBOC.
- varianta cu semnificație clinică incertă (VUS – variants with uncertain/unknown significance). Sunt variante referitoare la care nu există în momentul de față informații care să le coreleze cu HBOC.
- negativ – semnifică prezența doar a variantelor cu semnificație clinică benignă, fară mutații patogene. Este de menționat faptul că rezultatul negativ nu exclude riscul de a dezvolta HBOC la persoanele cu indicații/istoric.
Rezultat pozitiv
| Gena/ exon | Varianta | Modificare nucleotid | Modificare aminoacid | Referință | Semnificație clinică |
|---|---|---|---|---|---|
| BRCA2/ 23 | rs80357711 | c.9097delA | p.Thr3033 | Patogen |
| A fost identificată mutația NM_007300.3:c.4035delA de tip frameshift în exonul 10 al genei BRCA1 în status heterozigot. Această variantă constă într-o deleție (1pb) care determină modificarea cadrului de citire al genei BRCA1 începând cu codonul Glu1346. Noul cadru de citire se termină cu un codon STOP cu 19 poziții în aval de mutație, rezultând o proteină trunchiată. |
Management
Rezultatul interpretat necesită consiliere genetică posttestare. Explicarea rezultatului și a consecințelor sale este apanajul medicului genetician iar managementul cazului posttestare va fi stabilit multidisciplinar într-o echipă care cuprinde medicul oncolog, chirurgul oncolog, medicul de familie, psiholog și medicul genetician.
Consilierea genetică pre și posttestare.
Medicul genetician informează pacientul prin consilierea genetică pretestare asupra utilității și aplicabilității testului, avantajelor, dezavantejelor și riscurilor implicate, modalității de testare și implicațiilor medicale ale unui rezultat pozitiv sau negativ.
Consilierea genetică posttestare presupune prezentarea și explicarea rezultatelor și a consecințelor acestora asupra posibilului risc de cancer pentru pacient și rudele acestuia, discutarea riscului de transmitere a mutație la descendenți precum și expunerea planului de monitorizare, prevenție și/sau terapie pe termen lung.
Practic, consilierea genetică va cuprinde următoarele teme:
- ce este testul genetic pentru mutații în genele BRCA;
- motivul testării și percepția pacientului asupra testului și a riscului său de a dezvolta un cancer (unii membri asimptomatici ai familiei unui purtător/bolnav vor dori pur și simplu doar să știe ce risc au, alții însă vor solicita testarea cu scopul de a lua anumite decizii legate de planificarea unei sarcini, a unei cariere, rezolvarea unor probleme financiare….);
- alternativele de testare ( există bănci de ADN care oferă posibilitatea unei testări ulterioare a indivizilor afectați, atunci când metodologia de testare și cunoștințele avansate în domeniu ar permite poate o înțelegere mai bună a bolii);
- ce metodă se folosește și cum funcționează aceasta;
- în cât timp va primi un rezultat;
- ce fel de rezultat va furniza testul și ce implicații are fiecare dintre acestea ( consecințele unui rezultat pozitiv/negativ/neinformativ asupra riscului de cancer, protocolului de screening al cancerului, riscului altor membri ai familiei);
- inabilitatea testului de a identifica prezența/absența cancerului ( înțelegerea corectă a noțiunii de predispoziție);
- identificarea altor rude afectate care ar putea fi testate ( istoric familial de cancere pe cel puțin 3 generații);
- consilierea posttestare pentru explicarea rezultatului;
- plan de monitorizare posttestare dacă rezultatul este negativ;
- opțiuni posttestare dacă rezultatul este pozitiv (chemoprevenție, chirurgie preventivă);
- posibilitatea testării prenatale în situația când se planifică o sarcină;
- starea emoțională a pacientului (vina de a fi putătorii și transmițătorii unei astfel de mutații de predispoziție, teama de boală, chiar depresia sunt aspecte ce nu pot fi neglijate într-o discuție pre-testare indiferent că individul este deja bolnav sau doar posibil purtător);
- semnarea unui consimțământ informat pentru testare.
În mod concret, în practică pot fi întâlnite următoarele situații în care trebuie stabilit riscul de purtător de mutație patogenă în cazul altor membri ai familiei unei persoane care a fost testată și i s-a identificat o mutație patogenă BRCA1/2:
| Părinții probandului |
|---|
| Abordarea corectă indică efectuarea testului genetic ambilor părinți pentru a vedea de care parte a familiei este riscul. Deși teoretic unul dintre părinți ar trebui să fie purtător de mutație patogenă (fiind sau nu afectat de boală), în practică există situații în care nici unul dintre părinți nu va fi identificat ca purtător. În această situație (foarte rară) mutația probandului este aparută “de novo”. |
| Frații/surorile probandului |
|---|
| Riscul lor de a fi moștenit mutația depinde de statusul genetic al părinților, fiind de 50% pentru fiecare dintre ei, dacă unul dintre părinți are mutație; Riscul de a dezvolta HBOC depinde însă de penetranța respectivei mutații, de sexul și vârsta individului. |
| Copiii probandului |
|---|
| Au același risc de 50% de a moșteni mutația patogenă iar riscul de a dezvolta HBOC la un moment dat depinde de aceleași variabile (penetranță, sex, vârstă). |
| Alți membri ai familiei probandului |
|---|
| Riscul lor depinde de asemenea de statusul genetic al părinților probandului. Dacă unul dintre parinții probandului este purtător de mutație, ceilalți membri ai familiei vor avea riscuri diferite în funcție de gradul de înrudire. |
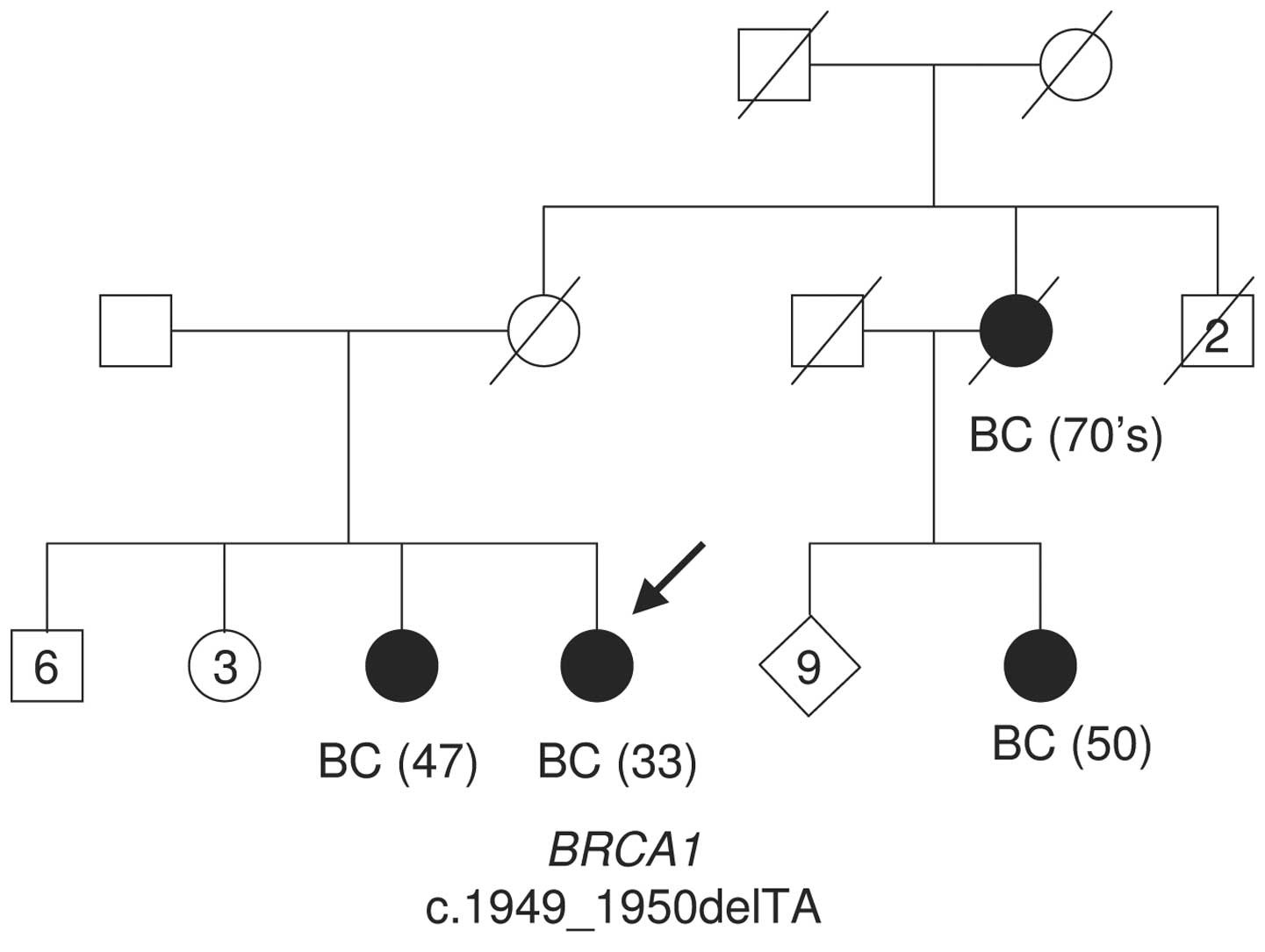
Figura 1 – Arbore genealogic al unei familii cu istoric de cancer
Numărul din paranteze semnifică vârsta la momentul diagnosticului. Săgeata indică probandul. cancer de sân, BC = cancer de sân

