- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Consult genetic
- Genetica medicala
ADAMTS-13 (proteaza factorului vonWillebrandt)
Denumire alternativă: ADAMTS-13 (proteaza FVW)
Preț: 698.00 lei
ADAMTS-13 (proteaza factorului von Willebrand) – activitate, antigen, anticorpi
Informații generale
ADAMTS13 (engl. a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13) este o metaloprotează care limitează agregarea plachetară și formarea de microtrombi în circulație prin clivarea factorului von Willebrand în multimeri cu greutate moleculară mică. Deficitul acestei proteaze datorat fie unei mutații a genei ADAMTS13, fie dezvoltării de autoanticorpi specifici (inhibitori) este implicat în patogenia purpurei trombotice trombocitopenice1.
Purpura trombotică trombocitopenică (PTT) este un sindrom trombotic microangiopatic rar (incidența este estimată la 3,7 cazuri la un milion), dar cu potențial fatal, caracterizat prin trombocitopenie, anemie hemolitică microangiopatică (hemoliză intravasculară și prezența de schizocite în sângele periferic), simptome neurologice, febră și afectare renală2;3. PTT afectează mai ales femeile, poate debuta la orice vârstă, cu un maxim între 30 – 40 de ani4.
Forma dobândită, primară, idiopatică a PTT este cea mai frecvent întâlnită, fiind asociată cu prezența de autoanticorpi, în timp ce deficitul congenital de ADAMTS 13 (sindromul Upshaw-Shulman) este foarte rar (<1% din cazurile de PTT). Forma secundară de PTT apare ca urmare a unor condiții clinice distincte (neoplazii, post transplant de organe sau celule stem, sepsis, tratament medicamentos) ce nu se asociază în general cu scăderea semnificativă a activității ADAMTS134.
Factorul von Willebrand (FVW) este o glicoproteină de adeziune, cu multiple roluri în coagulare, care circulă în plasmă sub forma unui amestec heterogen de multimeri. FVW este carrier pentru factorul VIII, având totodată un rol major în medierea proceselor de adeziune și agregare plachetară la nivelul suprafețelor endoteliale lezate.
Multimerii de FVW, sintetizați de megakariocite și de celulele endoteliale și stocați în α-granulele megakariocitare și în corpusculii Weibel-Palade din celulele endoteliale, variază ca mărime, de la dimerii de 600 000 D la multimerii foarte mari de 20 milioane D. Multimerii de dimensiuni foarte mari ai FVW (ultra large multimers of VWF-ULVWF) au efecte proadezive plachetare mai accentuate decât multimerii de dimensiuni mai mici ce se găsesc în mod normal în plasmă, prezența lor în circulație predispunând la formarea de microtrombi formați din trombocite și FVW ce vor determina ocluzia vaselor mici, substratul fiziopatologic al PTT.
FVW legat de colagenul expus ca urmare a injuriei vasculare se modifica conformațional în funcție de fluxul sanguin. Astfel, în condiții de flux rapid forma nepliată a FVW expune situsurile de legare pentru receptorii glicoproteici plachetari 1b/IX/V și αIIbβ3, facilitând aderarea trombocitelor la epiteliul lezat.
ADAMTS-13, principalul reglator al mărimii FVW, clivează ULVWF produși de celula endotelială, între Tyr1605– Met1606 la nivelul domeniului central A2, înaintea activării complete a acestora în torentul circulator. Activitatea proteolitică a ADAMTS-13 depinde atât de modificarea conformațională a FVW cât și de modificarea propriei conformații3;4;5;6.
ADAMTS-13 face parte din familia proteazelor dependente de calciu și zinc și este sintetizată de hepatocite, celule endoteliale, megakariocite sau trombocite, gena responsabilă fiind situată pe brațul lung al cromozomului 9 (9q34). Proteina este formată din 1427 resturi de aminoacizi și cuprinde patru regiuni funcționale distincte: centrul catalitic ce conține metaloproteaza, regiunea carboxi-terminală proximală ce conține o disintegrină, prima repetiție a trombospodinei 1 (TSP1-1), o secvență bogată în cisteină (Cys) și un domeniu spacer, regiunea carboxi-terminală mijlocie conține repetițiile 2-8 ale trombospodinei 1 (TSP1 2-8), iar regiunea carboxi-terminală distală conține două domenii CUB (C1r/C1s, urinary epidermal growth factor, bone morphogenetic protein) (fig.1).
Activitatea proteolitică a ADAMTS-13 depinde atât de modificarea conformațională a FVW cât și de modificarea propriei conformații. Interacțiunea dintre domeniile CUB și domeniul spacer, ce asigură conformația globulară normală a enzimei, împiedică expunerea situsului funcțional situat la nivelul domeniului spacer și, implicit, interacțiunea enzimei cu domeniul A2 al FVW. În condiții de flux rapid, domeniul C-terminal al FVW scindează legătura CUB-spacer ceea ce va conduce la deplierea și activarea conformațională a ADAMTS-13 5;7;8;9.
În faza acută a PTT, atât în forma congenitală cât și în cea dobândită prin mecanism autoimun, se înregistrează o scădere severă (< 5% sau < 10% din normal – în funcție de testul utilizat) a activității proteazice a ADAMTS13, aceasta deținând un rol central în fiziopatologia bolii6;8.
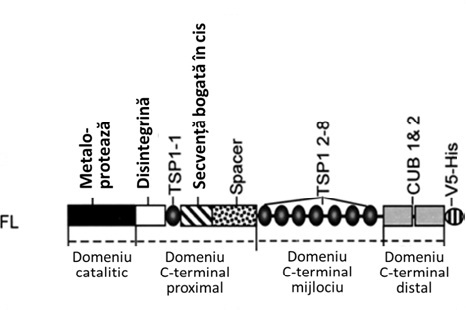
Fig.1 Domeniile structurale ale ADAMTS-13 (Adaptare după Ai J et al, J Biol Chem 2015)
Deficitul dobândit de ADAMTS-13
Autoanticorpii circulanți anti-ADAMTS-13 sunt prezenți la 94% -97% din pacienții cu PTT formă idiopatică/dobândită ce se prezintă cu scădere severă a activității enzimatice. În marea majoritate a cazurilor, aceștia au un efect de tip inhibitor asupra activității enzimatice, dar există un procent de 10%-15% din pacienți la care anticorpii se pare că acționează prin creșterea clearance-ului enzimatic.
Autoanticorpii sunt în special de tip IgG (predomină subclasa IgG4, urmată în ordinea frecvenței de IgG1, IgG2 și IgG3 ). În 97%-100% din cazuri autoanticorpii recunosc ca ținte antigenice primare aminoacizi situați în domeniul spacer al ADAMTS-13 (Arg568, Phe592, Arg660, Tyr661, și Tyr665). În pâna la 64% din aceste cazuri se pot asocia anticorpi care recunosc epitopi situați în alte domenii structurale ale enzimei (fig.2)8.
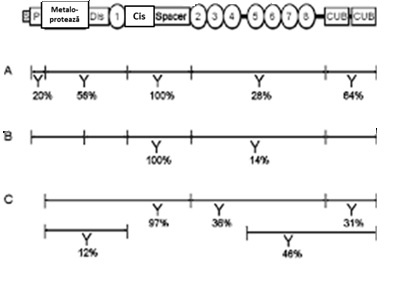
Fig.2 Domeniile structurale ale ADAMTS13 și localizarea epitopilor implicați în inducerea autoimunității (rândurile A-C)
(Adaptare după Kremer Hovinga JA and Lämmle B, ASH Educational Book, 2012)
Deficitul congenital de ADAMTS-13 ( sindromul Upsaw-Schulman)
PTT ereditară apare ca urmare a unor mutații genice compus heterozigote sau homozigote. Se cunosc peste 140 de mutații ale genei ADAMTS-13, dintre care aproximativ 60% sunt mutații missens, iar cca 20% sunt deleții si inserții; au mai fost identificate mutații nonsense și mutații ale regiunii de splicing introni-exoni.
Două din aceste mutații – inserția unei singure baze la nivelul exonului 29 (4143insA) și mutația missens Arg1060Trp la nivelul exonului 24 – au fost observate în familii neînrudite dintr-o arie geografică largă; astfel inserția 4143insA a fost identificată în jurul Marii Baltice, în Scandinavia și Moravia, în timp ce mutația Arg1060Trp a fost observată în Statele Unite, preculm și în multe țari din Europa. Mutațiile homozigote au fost identificate în special în familii consanguine8.
În laboratorul clinic pot fi utilizate mai multe metode pentru măsurarea activității ADAMTS13 și detectarea prezenței inhibitorilor1.
Recomandări pentru determinarea ADAMTS-13
- suspiciune clinică de PTT idiopatică sau congenitală (pacienții care se prezintă cu trombocitopenie – în special cu număr de trombocite între 10-30 x103/µl – și anemie hemolitică microangiopatică cu test Coombs direct negativ)3;4;9;
- evaluarea severității bolii, prognosticului, precum și a eficienței tratamentului 10;11;
- monitorizarea pacienților aflați în remisiune pentru identificarea cazurilor cu risc mare de recădere10;
- diagnosticul diferențial cu alte tulburări trombotice microangiopatice secundare (insuficiență hepatică, boli de țesut conjunctiv, sindromul hemolitic-uremic, post transplant de organe sau măduvă osoasă, CID, infecția HIV, neoplazii, tratament medicamentos, sarcină)3;4.
Pregătire pacient – proba de sânge va fi recoltată înainte de începerea plasmaferezei, la debutul episodului acut2.
Specimen recoltat – sânge venos12.
Recipient de recoltare – vacutainer cu citrat de Na 0.105M (raport citrat de sodiu – sânge=1/9). Presiunea realizată de garou trebuie sa fie între valoarea presiunii sistolice și cea a presiunii diastolice și nu trebuie să depășească 1 minut. Dacă puncția venoasă a eșuat, o nouă tentativă pe aceeași venă nu se poate face decât după 10 minute12.
Cantitate recoltata – se vor recolta 2 vacutainere cât permite vacuumul; pentru a preveni coagularea parțială a probei se va asigura amestecul corect al sângelui cu anticoagulantul, prin mișcări de inversiune a tubului12.
Prelucrare necesară după recoltare – proba va fi centrifugată 15 minute la 2500g, (de preferat dubla centrifugare pentru a obține plasma săracă în trombocite) urmată imediat de separarea plasmei și congelarea acesteia; probele recoltate în afara laboratorului vor fi transportate în recipientul destinat probelor congelate2;12.
Cauze de respingere a probei – probe coagulate, probe diluate cu fluide perfuzabile, plasma intens hemolizată, intens lipemică sau icterică, plasma decongelată în timpul transportului2;4;12.
Stabilitate probă – plasma separată este stabilă 4 săptămâni la – 20ºC12.
Metodă – ELISA.
În laborator se determină următorii parametrii:
– activitate ADAMTS13: măsoară forma liberă a proteinei11. Se utilizează un test ELISA funcțional cromogenic în care un fragment VWF recombinant ce conține domeniul A2 și situsul de clivare ADAMTS13 la Tyr1605– Met1606 este marcat cu glutation-S-transferază [GST]-histidină [GST-FVW73-His] și este imobilizat în godeurile plăcii ELISA cu ajutorul anticorpilor monoclonali anti-GST.
Se incubează apoi cu plasma pacientului; ADAMTS13 din probă va cliva o parte din substratul FVW73; în etapa următoare se adaugă anticorpi monoclonali marcați cu peroxidază din hrean (HRP) ce țintesc specific situsul de clivare ADAMTS13 al substratului VWF73 și se vor lega astfel doar de fragmentul VWF rezidual; în final se adaugă substratul cromogen TMB ce va fi degradat de HRP și va rezulta un produs colorat a cărui densitate optică va fi măsurată la 450 nm; cu ajutorul a 6 standarde se obține o curbă de calibrare cu ajutorul căreia va fi măsurată concentrația substratului VWF73 rezidual ce va fi invers proporțională cu activitatea ADAMTS13 din probă1;12.
– ADAMTS13 antigen: măsoară statusul total al proteinei ADAMTS13 ceea ce include: proteina liberă, proteina aflată în complexe antigen/anticorp inhibitor și ADAMTS13 legată de alți transportori11. Se utilizează anticorpi monoclonali anti-ADAMTS131;12.
– anticorpi anti-ADAMTS13: măsoară autoanticorpii specifici de tip IgG1;11;12.
Valori de referință:
Limita de detecție pentru ADAMTS-13 activitate este de 5%12.
Interpretarea rezultatelor
Determinarea activității ADAMTS-13 susține diagnosticul de PTT în puseul acut al bolii, pe când măsurarea antigenului poate oferi informații suplimentare cu privire la statusul bolii9.
PTT idiopatică în puseul acut
- scăderea severă (< 10% din normal) a activității ADAMTS13, împreună cu prezența anticorpilor de tip inhibitor sunt înalt sugestive pentru PTT idiopatică în puseu acut. Cu toate acestea, 40% din pacienții diagnosticați clinic cu PTT pot avea valori ale activității ADAMTS13 mai mari de 10%)4;10.
- titrurile crescute de anticorpi pot fi corelate cu întârzierea răspunsului la plasmafereză, boală refractară și prognostic rezervat10.
- nivelurile antigenului ADAMTS13 prezintă variații mari, de la deficit sever la valori ce intră în intervalul de normalitate, fără a exista o corelație strânsă cu scăderea activității. Se apreciază faptul că scăderea severă a antigenului în timpul episodului acut, se asociază statistic cu mortalitatea11.
PTT în remisiune (normalizarea numărului de trombocite și a LDH și menținerea acestora în parametrii normali la cel puțin 30 de zile de la ultima plasmafereză)
PTT congenitală
- se înregistrează o scădere severă (< 10% din normal) a activității ADAMTS13; autoanticorpii sunt de obicei absenți în PTT congenitală8
Sindromul hemolitic-uremic și alte tulburări trombotice microangiopatice secundare (transplant de organe sau de celule stem; boli hepatice; infecție HIV; DIC; sepsis; sarcină – preeclampsie, sindromul HELLP; terapie medicamentoasă: de ex. clopidogrel, ciclosporină, mitomicin C, chinină)4
– se asociază de cele mai multe ori cu scăderea ușoară sau moderată (<40% dar >5%) a activității ADAMTS13, dar există și cazuri asociate cu deficit sever de ADAMTS132;4;9.
Limite și interferențe
Valori fals scăzute:
Pot apare interferențe cu deteminarea activității ADAMTS13 atunci când în probă există niveluri endogene crescute de factor von Willebrand. Hiperlipidemia, hemoliza (hemoglobin plasmatică liberă >2g/L) și hiperbilirubinemia (concentrația bilirubinei > 100 μmol/L) pot determina valori scăzute ale activității2.
Valori fals normale se pot întâlnii atunci când probele se recoltează după plasmafereză sau transfuzie2.
Testul nu prezintă reactivitate încrucișată cu autoanticorpii (de ex. din lupusul eritematos sistemic) sau cu concentrațiile crescute de imunoglobuline G (de ex. din gamapatiile monoclonale)12.
Semnificația valorilor scăzute ale activității ADAMTS-13, fără anticorpi inhibitori sau fără mutații la nivelul genei este incertă6.
Bibliografie
-
ADAMTS13 Assays. Reference Type: Internet Communication. http://practical-haemostasis.com. A Practical Guide to Laboratory Haemostasis. 2012.
-
Mayo Clinic, Mayo Medical Laboratories. Reference Laboratory Services for Health Care Organizations. ADAMTS13 Activity and Inhibitor Profile. www.mayomedicallaboratories.com. 2016. Ref Type: Internet Communication.
-
Saifan C, Nasr R, Mehta S, Acharya PS, El-Sayegh S. Thrombotic Thrombocytopenic Purpura. In J Blood Disord Transfus, 2012, S3:001. doi:10.4172/2155-9864.S3-001.
-
Laboratory Corporation of America. Directory of Services and Interpretive Guide. ADAMTS13 Activity Reflex Profile. www.labcorp.com. 2016. Ref Type: Internet Communication.
-
South K.,Luken, B.M.,Crawley JTB.,Phillis R, Thomas M, Collins,R.,Deforche L, Vanhoorelbeke K and Lane DA. Conformational activation of ADAMTS 13. In PNAS 2014,vol.111,no.52,18578-18583, http://www.pnas.org/content/111/52/18578.full.
-
Tsai HM”Thrombotic Thrombocytopenic Purpura,Hemolytic-Uremic Syndrome,and Related Disorders” In Wintrobe’s Clinical Hematology, Greer J, Foerster J, Lukens J, Rodgers G, Pareskevas F, Glader B, Arber D, Means R.jr ,12th ed, Lippincott Williams & Wilkins, 2009, 1314-1325.
-
Ai J, Smith P,Wang S, Zhang P. and Zheng XL. The Proximal Carboxyl-terminal Domains of ADAMTS-13 Determine Substrat Specificity and Are All Required for Cleavage of von Willebrand Factor. In J.Biol.Chem. 2005,280, 29428-29434.
-
Kremer Hovinga JA and Lämmle B. Role of ADAMTS13 in the pathogenesis,diagnosis,and treatment of thrombotic thrombocytopenic purpura. In ASH Education Book, 2012 vol. 2012 no. 1. 610-616. http://asheducationbook.hematologylibrary.org/content/2012/1/610.full.pdf+html.
-
Scully M, Hunt BJ,Benjamin S, Liesner R, Rose P, Peyvandi F, Cheung B, Machin SJ. Guidelines on the diagnosis and management of thrombotic thrombocytopenic purpura and other thrombotic microangiopathies. In British Journal of Haematology,2012, 158(3):323-35.
-
Sadler JE. Von Willebrand factor,ADAMTD13, and thrombotic thrombocytopenic purpura. In Blood, 2008,112, 11-18.
-
Yang S, Jin M, Lin S, Cataland S, and Wu H. ADAMTS13 activity and antigen during therapy and follow-up of patients with idiopathic thrombotic thrombocytopenic purpura: correlation with clinical outcome. In Haematologica 2011;96(10):1521-1527.
-
Laborator Synevo. Referințele specifice tehnologiei de lucru utilizate, 2016. Ref Type: Catalog.
Produsul a fost adăugat în coș
În plus, ai la dispoziție 30 de zile pentru a veni la recoltare.
