- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Consult genetic
- Genetica medicala
Analiză cromozomială neoplazii hematologice (măduvă osoasă)
Preț: 1015.00 lei
Informații generale și recomandări
Un domeniu medical în care examenul citogenetic își găsește aplicații este oncologia. Dacă pentru tumorile solide variabilitatea foarte mare a modificărilor cariotipice face dificile deciziile terapeutice, pentru leucemii și limfoame există numeroase date clinice care atestă asocierea directă a unor rearanjări cromozomiale specifice cu tumorigeneza și permit instituirea unor tratamente țintite.
Astfel, cariotiparea celulelor tumorale pentru identificarea anomaliilor cromozomiale dobândite utlizând analiza cromozomială convențională și tehnica FISH la pacienții cu diverse neoplazii hematologice au devenit din ce în ce mai importante în managementul acestor boli.
Deși tehnicile moleculare s-au dezvoltat mult în ultimii ani și au devenit obligatorii pentru evaluarea anumitor subtipuri de leucemii, acestea nu pot încă să înlocuiască citogenetica convențională1.
Pot beneficia de analiza cariotipului tumoral pacienții cu următoarele categorii de afecțiuni hematologice:
- Neoplazii mieloide
- Leucemia mieloidă cronică (LMC) – atât în scop diagnostic cât și de monitorizare a bolii până la obținerea remisiunii citogenetice; detectarea unor anomalii cromozomiale noi (evoluție clonală citogenetică) la pacienții cu recăderi ale bolii, răspuns parțial/absent la tratament sau progresie către faza accelerată/criză blastică.
- Leucemia acută mieloblastică (LAM) – la diagnostic, pentru încadrarea corectă în grupuri de risc conform clasificării OMS, cu impact asupra prognosticului și deciziilor terapeutice; dacă este detectată o anumită anomalie citogenetică se poate recurge la monitorizarea acesteia după tratament sau în faza de recădere a bolii; dacă nu este detectată nicio aberație la diagnostic se poate indica efectuarea cariotipului tumoral în faza de recădere a bolii.
- Sindroame mielodisplazice (SMD) – la diagnostic, pentru stabilirea prognosticului și a deciziilor terapeutice; cariotipul poate fi indicat și pentru monitorizarea progresiei bolii sau a răspunsului la tratament; la pacienții cu citopenii detectarea unor anomalii citogenetice definitorii pentru SMD stabilesc diagnosticul chiar în absența criteriilor morfologice de displazie.
- Alte neoplasme mieloproliferative – la diagnostic, doar în cazuri selectate și în special pentru excluderea LMC și a evalua o posibilă transformare în leucemie acută.
- Neoplazii limfoide
- Leucemia acută limfoblastică (LAL) – la diagnostic, pentru încadrarea corectă în grupuri de risc conform clasificării OMS, cu impact asupra prognosticului și deciziilor terapeutice; dacă este detectată o anumită anomalie citogenetică se poate recurge la monitorizarea acesteia după tratament sau în faza de recădere a bolii; dacă nu este detectată nicio aberație la diagnostic se poate indica efectuarea cariotipului tumoral în faza de recădere a bolii.
- Leucemia limfatică cronică (LLC) – la diagnostic, pentru a avea unele indicații prognostice, pentru monitorizarea progresiei bolii și în faza de recădere.
- Limfoame cu celulă B sau T– la diagnostic, în cazuri selectate pentru stabilirea prognosticului, monitorizarea evoluției și a recăderilor2.
Pentru detectarea modificărilor cromozomiale asociate cu cancerele hematologice sursa optimă de celule este măduva osoasă. Dacă acest tip de probă nu este disponibil poate fi utilizat ca alternativă sângele periferic, condiția fiind ca în sânge să fie prezent un număr suficient de celule maligne (de regulă > 10%). Pentru LLC se preferă adesea sângele periferic; pentru limfoame proba de elecție este țesutul ganglionar proaspăt, probele de măduvă osoasă fiind indicate doar în cazurile în care este prezent un infiltrat limfoid la examenul morfologic2.
Modificările cromozomiale observate în urma efectuării cariotipului tumoral la pacienții cu neoplazii hematologice sunt variate, multiple și interesează majoritatea cromozomilor umani: translocații, inversii, duplicații, trisomii, monosomii, deleții, izocromozomi, cromozomi inelari, ș.a3.
Leucemia mieloidă cronică
Leucemia mieloidă cronică (LMC) – prototipul afecțiunilor leucemice – constituie o boală clonală a celulei stem hematopoietice ce conduce predominant la proliferarea excesivă a elementelor seriei granulocitare aflate în toate stadiile de maturație. LMC a fost prima afecțiune hematologică malignă identificată a fi asociată cu anomalii cromozomiale4.
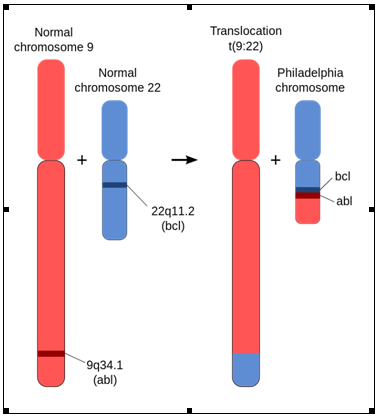
Modificarea cromozomială observată la pacienții cu LMC este translocația reciprocă produsă între brațele lungi ale cromozomilor 9 și 22 – t(9;22)(q34;q11) – cu formarea cromozomului derivativ denumit cromozomul Philadelphia (Ph). Această translocație are drept rezultat juxtapunerea genei tirozin kinazei ABL1 (Abelson) de pe cromozomul 9 lângă gena BCR (Breakpoint Cluster Region) de pe cromozomul 22 cu formarea genei de fuziune BCR-ABL1 (fuziune cap-coadă capăt 5’ BCR – capăt 3’ ABL)4;3;5.
Translocație reciprocă (9;22) – cromozomul Philadelphia6
Conform recomandărilor ELN (European LeukemiaNet) cariotipul din măduva osoasă trebuie efectuat obligatoriu la diagnostic, după 3 luni și 6 luni de la începerea tratamentului, iar apoi la fiecare 6 luni până la obținerea remisiunii complete. Poate fi necesară o monitorizare mai frecventă a pacienților care au avut anomalii citogenetice suplimentare la diagnostic și prezintă un răspuns nefavorabil la tratament.
Translocația t(9;22)(q34;q11) este detectată în 90-96% din cazurile de LMC la diagnostic. Restul de 5-10% din cazuri prezintă fie o variantă de translocație t(9;22) ce implică un alt cromozom sau o rearanjare BCR-ABL criptică, nedetectabilă la efectuarea cariotipului convențional. Din acest motiv, tehnica FISH cu sonde pentru BCR și ABL1 este obligatorie în situația în care la citogenetica convențională nu se depistează t(9;22)(q34;q11)2;7.
Leucemia acută mieloblastică
Leucemia acută mieloblastică (LAM) este caracterizată prin expansiunea clonală a precursorilor mieloizi nediferențiați ce conduce la perturbarea hematopoiezei și la insuficiență medulară8.
Cele mai frecvente modificări cromozomiale asociate acestei patologii sunt observate la nivelul cromozomilor umani 16, 3, 11, 22, 6, 8, 9, 5, 7 (genele ETO/RUNX1, AML1/RUNX1T1, KMT2A/MLL, CBFB, MYH1, MYH11, EV11, PML, RARA, ș.a.)5;9.
Detectarea anomaliilor cromozomiale la pacienții cu LAM este esențială pentru stratificarea în funcție de risc conform clasificării OMS și instituirea terapiei adecvate.
Grupul citogenetic cu evoluție favorabilă include:
- translocația t(8;21)(q22;q22) – asociată în principal cu LAM cu maturație
- translocația t(15:17)(q22;q12) – asociată cu leucemia acută promielocitară
- inversiile la nivelul cromozomului 16 – inv(16)(p13.1q22) sau t(16;16)(p13.1;q22) – asociate cu subtipul M4Eo de leucemie mielomonocitară cu eozinofile anormale.
Grupul citogenetic cu evoluție nefavorabilă (cu risc înalt) include:
- translocația t(6;9)
- translocația t(3;3)
- cariotipul complex (>3 anomalii cromozomiale clonale)
- cariotipul monosomal (cel puțin 2 monosomii autozomale, sau o monosomie autozomală și o anomalie cromozomială structurală)
- delețiile: – 5, 5q-, -7, 7q-, 11q23 – non- t(9;11)
- translocația t(9;22).
Grupul citogenetic cu risc intermediar include:
- LAM cu cariotip normal
- trisomia 8 izolată
- translocația t(9;11).
De menționat că anomaliile moleculare (mutațiile somatice) detectate suplimentar pot redefini încadrarea pacienților cu LAM în grupurile de risc descrise 10.
Sindromul mielodisplazic (SMD)
Sindromul mielodisplazic (SMD) reunește un grup de afecțiuni heterogene ale celulei stem hematopoietice caracterizate prin hematopoieză ineficientă și risc crescut de transformare în LAM.
Pentru confirmarea diagnosticului clinic de SMD, sunt importante examenul morfologic al aspiratului medular și cariotipul din măduva osoasă. Eventualele anomalii citogenetice reprezintă un indicator pentru riscul de dezvoltare a LAM3.
Printre modificările cromozomiale observate la pacienții cu SMD, cele mai frecvente sunt monosomiile parțiale 5q, 7q, 20q (deletii 5q / 7q / 20q – lipsa brațului lung) sau prezența unor rearanjamente cromozomiale complexe (modificări la nivelul mai multor cromozomi)3;5.
Anomaliile cromozomiale recurente (detectate obligatoriu prin analiză citogenetică convențională) menționate în clasificarea OMS 2008 a neoplaziilor mieloide și leucemiilor acute (și care se mențin și în noua clasificare OMS din 2016) pot stabili diagnosticul de SMD la pacienții cu citopenie, chiar în absența modificărilor morfologice de displazie. Acestea sunt reprezentate de: delețiile – 5, 5q-, -7, 7q-, -13, 13q-, 11q-, 12p-, 9q-, izocromozomul brațului lung al cromozomului 17 i(17q), cromozomul izodicentric X cu punct de ruptură la nivelul Xq13 –idic(X)(q13, translocațiile t(11;16)(q23;p13.3), t(3;21)(q26.2;q22.1), t(1;3)(p36.3;q21.1), t(2;11)(p21;q23), inv(3)(q21q26.2), t(6;9)(p23;q34) și cariotipul complex. Prezența trisomiei 8 și a delețiilor –Y, 20q- nu este considerate definitorie pentru SMD decât în prezența modificărilor de displazie. Deleția 5q- este singura anomalie citogenetică ce delimitează un subtip SMD specific. Deși modificările de cariotip nu definesc alte subtipuri de MDS acestea permit clasificarea pacienților în 5 grupuri de risc, conform scorului IPSS-R11;12.
Leucemia acută limfoblastică
Leucemia acută limfoblastică (LAL) se caracterizează prin expansiunea clonală a unor precursori limfoizi imaturi din măduva osoasă cu perturbarea hematopoiezei normale și, adesea, cu infiltrarea țesuturilor extramedulare.
LAL cu celule B (LAL-B) este mult mai frecventă decât forma cu celule T (LAL-T), fiind responsabilă de 85% din cazurile de LAL ale copilului și 75% din cele survenite la adult.
Atât numărul cât și alterările structurale ale cromozomilor reprezintă un element de prognostic independent în LAL și permit încadrarea pacienților în categoriile definite de OMS.
Astfel, copiii ai căror limfoblaști prezintă hiperdiploidie (>50 cromozomi) au perioade mai lungi de remisiune și o rată mai bună de supraviețuire în comparație cu alte grupuri citogenetice. Mai mult, hiperdiploidia înaltă (>53 cromozomi) este asociată cu o rată de recădere mult mai mică. Prognosticul favorabil al hiperdiploidiei s-ar datora prezenței simultane a trisomiilor 4 și 10 sau a trisomiilor 4, 10 și 17. Pe de altă parte, hipodiploidia severă (prezența unei clone cu <44 cromozomi) conferă un prognostic nefavorabil, în ciuda tratamentului intensiv.
Translocațiile cromozomiale clonale reprezintă de asemenea un marker important de prognostic în LAL.
Un subset de LAL cu un prognostic nefavorabil, caracterizat prin recădere precoce după chimioterapie, prezintă o translocație ce implică gena MLL (Mixed Lineage Leukemia, denumire nouă KMT2A) de pe segmentul cromozomial 11q23. Cele mai frecvente translocații de acest fel sunt t(4;11)(q21;q23) asociată adesea cu LAL la sugari, t(6;11)(q27;q23), t(9;11)(p22;q23) și t(11;19)(q23;p13). Principalii parteneri de fuziune ai genei MLL sunt AF4 pe cromozomul 4, AF6 pe cromozomul 6, AF9 pe cromozomul 9 și, respectiv, ENL pe cromozomul 19.
Translocația t(12;21)(p13;q22) ce are drept rezultat apariția genei de fuziune ETV6-RUNX1 (TEL-AML1) este detectată la 25% dintre copiii cu leucemie cu precursor de celulă B (tipic, >2 ani), fiind asociată cu un prognostic favorabil.
Translocația t(1;19)(q23;p13) este întâlnită la aproximativ 25% dintre pacienții cu imunofenotip pre-B cIg+. Această translocație este rezultatul fuziunii genei E2A de pe cromozomul 1 cu gena PBX1 de pe cromozomul 19. Prognosticul nefavorabil conferit de această translocație este contracarat în prezent de protocoalele de tratament intensiv.
Translocațiile ce afectează locusul c-MYC de pe 8q24 împreună cu unul din locusurile Ig de pe 14q32, 2p12 sau 22q11 sunt caracteristice leucemiei cu celulă B matură (Burkitt) și nu pot fi deosebite de t(8;14) și alte translocații asociate care apar în limfomul Burkitt. Și în această formă chimioterapia intensivă a anulat prognosticul infaust determinat de aceste translocații.
Cromozomul Philadelphia rezultat ca urmare a translocației t(9;22)(q32;q11) este prezent la ~20-30% dintre adulții și 1-5% dintre copiii cu LAL; se asociază cu număr mare de leucocite, vârstă mai înaintată, sexul masculin și morfologie FAB-L213;14.
Alterări în expresia genei TAL1/SCL (T-cell acute lymphoblastic leukemia 1/stem cell leukemia) sunt cele mai frecvente anomalii în LAL-T; gena TAL1/SCL a fost clonată inițial din translocația t(1;14)(p34;q11) prezentă în 3% din cazurile de T-LAL.
Delețiile sau translocațiile care afectează cromozomul 9p sunt întâlnite în ~10% din cazurile de LAL la copii și sunt asociate cu un număr mare de leucocite la debut, masă mediastinală, imunofenotip T și un risc crescut de recădere. Gena inhibitorului 4 de kinază dependent de ciclină (CDKN2 sau p16ink4) localizată pe 9p21 suferă deleție în >20% din cazurile de LAL sau alte neoplazii limfoide15.
Leucemia limfatică cronică
LLC este cea mai frecventă formă de leucemie la populația caucaziană, cu simptomatologie variabilă, de la cazuri neutre până la variante severe și agresive de boală, cu evoluție rapidă.
Cea mai des întâlnită aberație cromozomială la pacienții cu LLC (peste 50% din cazuri) este deleția 13q14 de la nivelul bratului lung al cromozomului 13, cu afectarea genei RB1.
Trisomia cromozomului 12 este de asemenea una dintre anomaliile genetice comune (10-20% din cazuri). De multe ori, trisomia este singura modificare observată la pacienții cu LLC, însă deseori poate fi însoțită și de alte aberații cromozomiale (trisomii 18, 19, deleții 13q, 14q, 11q, 17p, translocații incluzând gena IGH, s.a.). Spre deosebire de del(13q14) asociată cu prognostic favorabil, trisomia 12 conferă un risc intermediar.
Deleția brațului lung al cromozomului 11 – del(11q23) este detectată la 5-10% din pacienții cu LLC și este inclusă în categoria anomaliilor citogenetice cu risc crescut.
O altă anomalie cromozomială identificată la 3-8% din pacienții cu LLC la diagnostic și în până la 30% din cazurile refractare la chimioterapie este deleția parțială a brațului scurt al cromozomului 17 – del(17p), cu alterarea genei p53 și perturbarea ciclului celular. Pacienții cu del17p sunt încadrați în grupul de risc foarte înalt16.
Limfomul Hodgkin
Limfomul Hodgkin (LH) este una dintre cele mai frecvente forme de cancer limfatic la nivel mondial.
Din punct de vedere citogenetic, anomaliile cromozomiale observate mai frecvent la pacienții cu LH au fost modificari structurale la nivelul cromozomilor 1 și 11, monosomii parțiale 6q și 7q – del(6q) / del(7q), duplicații la nivelul brațului lung al cromozomului 14 – dup(14q), precum și trisomii ale cromozomilor 3 sau 7. Translocații ce includ gena BCL3 (locatie cromozomiala 19q13.32), precum și modificări cce conțin regiunea 4q25-q28 au fost de asemenea raportate la unii dintre pacienți3;5.
Limfoame non-Hodgkin
Limfoamele non-Hodgkin (LNH) reprezintă un grup de afecțiuni maligne în a căror etiologie au fost implicați agenți infecțioși, factori de mediu, imunosupresie, inflamație cronică sau rearanjamente cromozomiale.
Anomaliile citogenetice întâlnite cel mai frecvent la pacienții cu LNH sunt modificări structurale care includ regiunea cromozomială 14q32 (gena IGH), cum sunt translocațiile reciproce t(14;18)(q32;q21) și t(8;14)(q24;q32), cu formarea genelor de fuziune BCL2/IGH, respectiv cMYC/IGH. Alte aberații cromozomiale raportate la acești pacienți sunt monosomia parțială 6q – del(6q), izocromozomul 17 – i(17q), trisomii ale cromozomilor 3, 7, 12, 18 sau 21, duplicații la nivelul brațelor scurte ale cromozomilor 2 și 3 – dup(2p), dup(3p), precum și modificări structurale la nivelul cromozomului 17 (ultimele fiind predictive pentru o evoluție agresivă a bolii)5;17.
Limfomul Burkitt este o formă de LNH cu celule B care apare in special la copii și tineri. Dintre cele 3 tipuri de LB (sporadic, endemic și imunodeficitar), tipul sporadic este cel identificat la nivelul populatiei generale (cel endemic fiind determinat de virusul Epstein-Barr în special la populația africană și cel imunodeficitar fiind prezent la pacienții cu HIV/SIDA). LB este o afecțiune extrem de agresivă care poate afecta sistemul nervos central, măduva osoasă, mezenterul, vezica urinară, rinichii, ovarele și alte organe.
Modificarea citogenetică definitorie pentru LB (identificată în 60-70% dintre cazuri) este translocația reciprocă produsă între bratele lungi ale cromozomilor 8 și 14 – t(8;14)(q24;q32) cu formarea genei de fuziune IGH-cMYC – denumita și translocația Burkitt. Această aberație cromozomială este sinonimă cu o evoluție agresivă a afecțiunii1.
Alte translocații reciproce care interesează regiunea cromozomială 8q24 (gena cMYC) – t(8;22)(q24;q11) și t(2;8)(p12;q24) asociate cu genele de fuziune IGL/cMYC, respectiv (IGK/cMYC) – sunt considerate variante ale translocației Burkitt.
La un număr mic de cazuri au fost observate duplicații la nivelul brațului lung al cromozomului 1 (1q21-q25) 3;5.
| AFECȚIUNE HEMATOLOGICĂ | MODIFICĂRI CROMOZOMIALE |
| Leucemie mieloidă cronică (LMC) | t(9;22)(q34;q11)
(BCR-ABL/cromozom Philadelphia) |
| LMC – faza blastică | trisomie 8
t(9;22)(q34;q11) (BCR-ABL) trisomie 19 i(17q) |
| Leucemie acută mieloblastică (LAM) | t(8;21)(q22;q22) (ETO-AML1/5`RUNX1-3`RUNX1T1)
inv(16)(p16;q22) (CBFB-MYH11) t(15;17)(q24;q21) (PML-RARA) monosomie 5 / del(5q) monosomie 7 / del(7q) abn(3q): inv(3)(q21q26.2), t(3;3)(q21;q26.2), s.a. inv(16)(p13q22) (CBFB-MYH1) t(11q23) (variante KMT2A/MLL) t(6;9)(p23;q34) (DEK-CAN) t(3;3)(q21;q26)/inv(3)(q21q26) (varianta EV11) t(3;5)(q25.1;q34) (NPM-MLF1) t(7;11)(p15;p15) (NUP98-HOXA9) t(16;21)(p11;q22) (FUS-ERG) |
| Sindrom mielodisplazic (SMD) | del(5q) / monosomie 5
del(7q) / monosomie 7 monosomie 8 cariotip complex |
| SMD cu leucemie acută secundară | del(5q) / monosomie 5
del(7q) / monosomie 7 del(20q) / monosomie 20 |
| Leucemie acută limfolastică (LAL)
LAL-B
LAL-T |
t(9;22)(q34;q11) (BCR-ABL)
t(12;21)(p13;q22) (TEL-AML1) t(1;19)(q23;p13) (PBX-E2A /TCF3) t(5;14)(q31;q32) (IL3-IGH) t(8;14)(q24;q32) (IgH-MYC) t(4;11)(q21;q23) (KMT2A/MLL-AFF1) t(11;19)(q23;p13) (variante KMT2A/MLL) t(17;19)(q22;p13) (HLF-E2A) t(1;14)(p32;q11) (TAL1-TCRD) t(1;7)(p32;q35) (TAL1-TCRB) t(7;9)(q35;q34) (TCRB-TCL4) t(7;10)(q35;q24) (TCRB-HOX11/TCL3) t(7;11)(q35;p13) (TCRB-RBTN2) t(7;19)(q35;p23) (TCRB-LYL1) t(10;14)(q24;q11) (HOX11/TCL3-TCRD) t(11;14)(p13;q11) (TCRD-LMO1) t(11;14)(p15;q11) (TCRD-LMO2) |
| Limfoame non-hodgkin (LNH)
Limfom Burkitt (LB) |
t(14;18)(q32;q21) (BCL2-IgH)
t(8;14)(q24;q32) (cMYC-IgH) t(2;8)(p12;q24) (cMYC-IgK) t(8;22)(q24;q11) (cMYC-IgL) t(11;14)(q13;q32) (BCL1-IgH) t(2;3)(p13;q27) (IgK-BCL6) t(2;5)(p23;q35) (NPM-ALK) t(3;14)(q27;q32) (BCL6-IgH) t(3;22)(q27;q11) (BCL6-IgL) |
| t(8;14)(q24;q32) (IgH-cMYC)
t(8;22)(q24;q11) (IgL-cMYC) (variantă translocația Burkitt) t(2;8)(p12;q24) (IgK-cMYK) (variantă traslocația Burkitt) |
|
| Limfom Hodgkin (LH) | modificări structurale cromozomi 1 și 11
del(6q) / monosomie 6 dup(14q) trisomie 7 trisomie 3 |
Modificari genetice observate la pacienții cu diferite tipuri de afecțiuni hematologice maligne1-17
Specimen recoltat – măduvă osoasă recoltată prin puncție aspirativă medulară într-o seringă heparinizată ce va fi descărcată rapid în vacutainer18.
Recipient de recoltare – vacutainer ce conține heparină sodică ca anticoagulant18.
Volumul minim necesar – 3 mL aspirat medular18.
Prelucrare necesară după recoltare – omogenizarea probei. Proba se va trimite imediat la laborator în vederea inițierii culturilor celulare; dacă acest nu este posibil, proba se va păstra la 20-25°C maxim 24 de ore18.
Transportul probelor – se va efectua cu respectarea condițiilor de stabilitate a probei: la 20-250C, maxim 24 ore din momentul recoltării probei până la intrarea acesteia în lucru18..
Criterii de respingere a probei – recoltare pe vacutainer incorect; volum insuficient; probe vechi sau coagulate18.
Metodă – tehnica clasică de bandare G; se va suplimenta cu testări FISH în funcție de tipul neoplaziei hematologice18.
Limite și interferențe
Puteți descărca formularul AICI.
Bibliografie
-
Constance K. Stein. Applications of Cytogenetics in Modern Pathology. In Henry’s Clinical Diagnosis and Management by Laboratory Methods- Sauders Elsevier 21-Ed 2007, 1274-1276.
-
Ross Hastings, Rod Howell, David Betts, Sarah Porter, Claudia Haferlach, Nicole Dastugue et al. Guidelines and Quality Assurance for Acquired Cytogenetics. E.C.A. – European Cytogeneticists Association Newsletter No 131, January 2013.
-
Hardi F, Sudoyo AW. Cytogenetics in oncology: From hematologic malignancies to solid tumors. Med J Indones 2009; 18(1):69-75.
-
Kaaren K. Reichard, Richard S. Larson, Ian Rabinowitz. Chronic Myeloid Leukemia. In Wintrobe`s Clinical Hematology, Greer J, Foerster J, Lukens J, Rodgers G, Pareskevas F, Glader B, 12th ed, Lippincott Williams & Wilkins, 2009, 2006-2015.
-
Chen Z. Molecular cytogenetic markers related to prognosis in hematological malignancies. World J Pediatr 2006; 2(4):252-259.
- Baccarani M, Deininger MW, Rosti G, Hochhaus A, Soverini S, Apperley JF, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013 Aug 8;122(6):872-84.
- Döhner H, Weisdorf DJ, Bloomfield CD. Acute Myeloid Leukemia. N Engl J Med. 2015 Sep 17;373(12):1136-52.
- Wang ML, Bailey NG. Acute myeloid leukemia genetics. Risk stratification and implications for therapy. Arch Pathol Lab Med 2015; 139:1215-1223.
-
Kansal R. Acute myeloid leukemia in the era of precision medicine: recent advances in diagnostic classification and risk stratification. Cancer Biol Med. 2016 Mar;13(1):41-54.
-
Vardiman JW, Thiele J, Arber DA, Brunning RD, Borowitz MJ, Porwit A, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009 Jul 30;114(5):937-51.
-
Arber DA, Orazi A, Hasserjian R, Thiele J, Borowitz MJ, Le Beau MM et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016 May 19;127(20):2391-405.
-
Loh ML, Mullighan CG. Advances in the Genetics of High-Risk Childhood B-Progenitor Acute Lymphoblastic Leukemia and Juvenile Myelomonocytic Leukemia: Implications for Therapy. Clin Cancer Res 2012; 18(10):2754–67.
-
Moorman AV, Ensor HM, Richards SM, Chilton L, Schwab C, Kinsey SE et al. Prognostic effect of chromosomal abnormalities in childhood B-cell precursor acute lymphoblastic leukaemia: results from the UK Medical Research Council ALL97/99 randomised trial. Lancet Oncol. 2010 May;11(5):429-38.
-
Mary Ann Thompson. Molecular Genetics of Acute Leukemia. In Wintrobe`s Clinical Hematology, Greer J, Foerster J, Lukens J, Rodgers G, Pareskevas F, Glader B, 12th ed, Lippincott Williams & Wilkins, 2009, 1791-1804.
-
Puiggros A. Blanco G, Espinet. B. Genetic abnormalities in chronic lymphocytic Leukemia: where we are and where we go. BioMed Research Internatioal 2014; http://dx.doi.org/10.1155/2014/435983.
-
Levine EG, Bloomfield CD. Cytogenetics of non-Hodgkin’s lymphoma. J Natl Cancer Inst Monogr 1990; 10:7-12.
-
Laborator Synevo. Referințele specifice tehnologiei de lucru utilizate 2017. Ref Type: Catalog.
Informatii utile despre "Analiză cromozomială neoplazii hematologice (măduvă osoasă)"
Produsul a fost adăugat în coș
În plus, ai la dispoziție 30 de zile pentru a veni la recoltare.