- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Consult genetic
- Genetica medicala
Evaluare functională a tractului digestiv (GI Effects®)
Preț: 3186.00 lei
Atenție! Această analiză se efectuează doar în baza unei programări în oricare centru de recoltare Synevo. Datele de contact ale locațiilor aici.
Informații generale – Evaluare functională a tractului digestiv (GI Effects®)
Termenul „microbiotă” definește flora microbiană, alcatuită din microorganisme simbiotice, comensale și patogene (cunoscute și sub numele de patobionți) găzduite de organismul uman într-un anumit mediu (de exemplu în intestin). Estimări recente sugerează că raportul dintre celulele bacteriene și cele umane este de aproximativ 1:1.
Microbiota intestinală include 1.000 – 1.500 de specii bacteriene; însă cu toate acestea, un individ prezintă doar aproximativ 160 specii bacteriene, indicând faptul că această compoziţie a microbiomul este substanțial diferită între indivizi și este legată de schimbările de mediu și modificările genetice moștenitre1,2. Factorii de mediu joacă un rol foarte important în dezvoltarea microbiotei intestinale. O serie de metaanalize confirmă că ea este influențată în principal de varietatea dietei, vârsta și statusul inflamator al mucoaselor1.
Compoziția microbiană și colonizarea sunt influențate de factori precum modalitatea de naştere a fătului, alăptarea, dieta, tratamentul cu antibiotice și prematuritatea3.
Atunci când există un dezechilibru între speciile microbiene intestinale, apare disbioza, care determină apariția unor boli intestinale. Studii efectuate pe animalele au arătat că absența microbiotei intestinale este corelată direct cu deficiențe ale sistemului imun. În plus, disbioza este corelată cu mai multe afecțiuni, cum ar fi: obezitatea, diabetul de tip 2, hipertensiunea arterială, enterocolita necrozantă (NEC) și boli inflamatorii intestinale (IBD), artrita inflamatorie sistemică, scleroza multiplă și lupusul eritematos sistemic (LES) 1,3.
Definiția microbiomului în biologie se referă la microorganisme și genele lor, în timp ce microbiota se referă exclusiv la populatiile microbiene. În ultimele decenii, tehnologia de secvențiere de noua generație (NGS) a contribuit la definirea și înțelegerea relației complexe dintre microbiom (totalitatea genomurilor bacteriene) și anumite afecțiuni. Înainte de apariția unor progrese tehnologice de secvențiere a ADN-ului, diversitatea microbiomului uman a fost mult subapreciată. Cel puțin 80% dintre microorganisme nu au putut fi identificate folosind tehnicile standard de cultivare pe medii de cultură.
Odată cu apariția secvențierii de nouă generație, bacteriile și arheele sunt acum identificate pe baza ARN-ului ribozomal din subunitatea mică (ARNr 16S), care prezintă regiuni conservate, comune majorității bacteriilor, precum și regiuni hipervariabile, unice pentru fiecare specie de bacterii. Aceasta a permis secvențierea și identificarea taxonomică a bacteriilor prezente într-o comunitate.
Secvențele genomului microbian conțin 3 × 106 gene, totalitatea genelor din microorganismele intestinale umane – cunoscute drept metagenom – fiind de aproximativ 150 de ori mai mare decât lungimea genomului uman. Rezultatele secvențierii au arătat că, într-un procent de 93,5%, bacteriile microbiomului uman sunt reprezentate de grupele filogenetice Bacteroidetes, Proteobacteria, Firmicutes, Actinobacteria sau Euryarchaeota.
Abordarea metagenomică, în care genomurile combinate ale unei comunități microbiene sunt studiate integral (inclusiv virusuri și fungi), a permis o caracterizare mai cuprinzătoare a microbiomului uman. Este completată de metatranscriptomică, care definește colecția de gene, exprimată de o anumită comunitate microbiană și de metaproteomică și metabolomică, care definesc proteinele și metaboliții lor (cum ar fi acizii grași cu lanț scurt și mediu) produși (sau metabolizați) în mod colectiv de către microorganisme. Secvențierea întregului genom este folosită pentru a identifica capacitatea funcţională sau enzimatică a microorganismelor identificate1,3,4.
Deși tehnologia de secvențiere poate fi utilizată pentru a profila o anumită comunitate microbiană, aceasta este limitată în definirea speciilor bacteriene și diferențierea între tulpinile comensale și patogene, în special în cazul transferului interbacterian, orizontal, de gene. În cadrul acestui transfer, o specie bacteriană obține factori de virulență de la o altă specie din mediul său, permițându-i să declanșeze o anumită afecțiune (de exemplu, acțiunea Bacteroides în complicația apărută post rectocolectomie totală, numită pouchită)3.
Microbiomul unei persoane este relativ stabil și rezistent în timp, însă există factori de mediu precum dieta, probioticele (care conțin bacterii benefice vii), prebioticele (care conțin suplimente ce favorizează creșterea bacteriilor specifice), virusuri și medicamente, în special antibiotice, care pot modifica compoziția florei bacteriene. Analiza compoziţiei microbiotei, combinat cu analiza biostatistică, demonstrează că la copiii gemeni există microbiote diferite, dar într-o măsură mai mică decât la cei care nu sunt gemeni, o astfel de diferenţă fiind mai puţin accentuată, comparativ cu persoanele neînrudite4,5.
Interacțiunile coordonate dintre populaţiile microbiene intestinale contribuie la menţinerea homeostaziei intestinale și joacă un rol important în fiziologia procesului imun. Relația simbiotică dintre microbiotă și gazdă este reciproc avantajoasă: gazda oferă un habitat și substanțe nutritive importante pentru microbiom, iar microbiota intestinală sprijină dezvoltarea sistemul metabolic și maturizarea intestinală a sistemului imun, prin furnizarea unor nutrienți, vitamine și acizi grasi cu lanț scurt (SCFA).
Prin urmare, interacțiunea dintre microbiom și sistemul imun intestinal sunt esențiale pentru a menține homeostazia mucoasei intestinale. Colonizarea rapidă a tractului gastrointestinal, la nou-născuți, joacă un rol esențial în dezvoltarea sistemului imun intestinal1.
Microbiota intestinală va avea deci, un rol esențial în procesul de fermentarea substraturilor nedigerabile, precum fibrele alimentare, iar acesta fermentație va susține creșterea microorganismelor, care produc acizi grași cu lanț scurt (SCFA) și gaze. SCFA produși de aceasta sunt reprezentați de: acetat, propionat, și butirat.
Butiratul, principalasursă de energie pentru celulele epiteliale intestinale, poate induce apoptoza celulelor tumorale și poate activa gluconeogeneza intestinală. Butiratul este esențial, menținând un nivel optim de oxigen în intestin și prevenind astfel disbioza. Propionatul este transferat în ficat, unde reglează gluconeogeneza şi senzația de saţietate, prin interacţiune cu receptorii intestinali pentru acizi grași.
Acetatul—cel mai abundent SCFA și metabolit esențial în creșterea bacteriană — ajunge în ţesuturi, unde este utilizat în metabolismul colesterolului și lipogeneză; este astfel un element important în reglarea centrală a apetitului alimentar. Studii randomizate au arătat că producția crescută de SCFA reduce obezitatea indusă de alimentaţie şi scade rezistenţa la insulină.
În studiile efectuate la șoareci s-a constatat că butiratul şi propionatul, par să controleze hormonii intestinali și reduc pofta de mâncare și astfel, aportul alimentar. Enzimele microbiene intestinale intervin în metabolismul acizilor biliari, generând acizi biliari neconjugati, care acționează ca molecule de semnalizare și/sau reglatori metabolici.
Alți metaboliți specifici microbiotei intestinale, implicați direct în mentinerea echilibrului intestinal sunt: trimetilamina și acid indolepropionic. Producția de trimetilamină din fosfatidilcolină și carnitina alimentară (din carne și lactate) depind de microbiota intestinală și, prin urmare, cantitatea acesteia în sânge suferă variații individuale. Trimetilamina este oxidata în ficat la N-oxid trimetilamină, care este asociată cu risc crescut de ateroscleroză şi evenimente cardiovasculare adverse majore. Acidul indolepropionic este corelat cu nivelul aportului de fibre alimentare iar activitatea sa de captare a radicalilor ’’in vitro’’, pare să reducă riscul incidenței diabetului de tip 25,6.
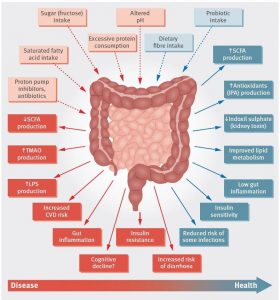
Adaptat dupa Role of the gut microbiota in nutrition and health BMJ 2018; 361 doi: https://doi.org/10.1136/bmj.k2179
Microbiomul îndeplinește deci, o serie de funcții importante:
- conferă protecție împotriva organismelor patogene care provoacă infecții (rol de bariera, dar și generator de metaboliti toxici pentru bacterii – H2O2, pH acid );
- faciliteaza digestia reziduurilor si a substraturilor alimentare nedigerate și neabsorbite (carbohidrati complecși – celuloza, hemiceluloza, pectina, amidon, lignina) în acizi grași cu lanț scurt (SCFA) – furnizează pana la 10% din necesarul de energie al organismului: acidul acetic este folosit de muschi, acidul propionic de ficat, acidul butiric furnizează energie la nivelul celulelor intestinale;
- are o acțiune antiinflamatoare, prin inhibarea histon-diacetilazelor din celulele T reglatoare (Tregs) prin receptorii cuplați cu proteinele G (GPR);
- contribuie la sinteza unor vitamine (B1, B2, B6, B12, K2, K, H) și de aminoacizi esențiali;
- contribuie la reglarea metabolismul lipidelor;
- contribuie la producerea unor neurotransmițători precum dopamina, serotonina, acetilcolina, GABA, melatonina și influenteaza activitatea axei endocrine hipotalamo-hipofizo-suprarenale;
- modelează dezvoltarea sistemului imun1,2,3,4,5,6,7.
Biomarkerii din testul de evaluare funcțională a tractului intestinal reflectă cele 3 funcții cheie ale sănătății intestinale9:
- Digestie/ absorbtie:
- Elastaza pancreatică – este un biomarker al funcției pancreatice
- Produși de metabolism ai proteinelor – sunt biomarkeri ai proteinelor nedigerate, care ajung la colon
- Lipide fecale – biomarker al descompunerii și absorbției grăsimilor.
- Inflamație/ status imunologic:
- Calprotectina – este un biomarker al inflamației determinate de neutrofile. Produs în abundență la nivelul zonelor de inflamație, acest biomarker s-a dovedit util din punct de vedere clinic în diferențierea dintre boala inflamatorie intestinală (IBD) și sindromul colonului iritabil (IBS).
- Proteina X eozinofilă – este un biomarker al inflamației determinate de eozinofile și al răspunsului alergic.
- IgA secretor fecal – este un biomarker de evaluare a imunității intestinale și a funcției de barieră.
- Depistare hemoragii oculte – screening-ul pacientilor asimptomatici, în scopul depistării cancerului colo-rectal
- Microbiomul intestinal:
- Indicatori metabolici, acizii grași cu lanț scurt și beta-glucuronidaza, evalueză funcțiile metabolice specifice și vitale, îndeplinite de microbiotă.
- Bacteriile comensale indică atât compoziția, cât și abundența relativă a microorganismelor
- Testul evaluează un set de 24 de genuri/specii care se mapează în 7 phyla majore.
- Culturile bacteriene și micologice demonstrează prezența unor organisme benefice și patologice specifice; sunt furnizate antibiograme pentru organismele patogene sau potențial patogene, ce au fost identificate;
- Examinarea microscopică, pentru evidențierea ouălor de paraziți și/sau paraziți.
- Tehnicile de PCR, care pot detecta următoarele clase de paraziți: Blastocystis cu subtipări reflexe, Cryptosporidium parvum/hominis, Cyclospora cayetanensis, Dientamoeba fragilis, Entamoeba histolytica și Giardia8.
Pregatire pacient:
- Nu prelevați în cazul în care există sângerări active din cauza hemoroizilor sau a menstruației
- Așteptați cel puțin 4 săptămâni de la colonoscopie sau clismă înainte de a începe testul
- Cu 2-4 săptămâni înainte de recoltare întrerupeți tratamentul cu: antibiotice antiparazitare, antifungice, suplimentele cu probiotice (14 zile de la ultima doză)
- Cu 14 zile înainte de recoltare întrerupeți tratamentul cu: antibiotice, inhibitori ai pompei de protoni (IPP) și bismut
- Cu 2 zile înainte de recoltare întrerupeți tratamentul cu: aspirina și alte AINS (de exemplu, ibuprofenul), supozitoare rectale, clisme, cărbune activat, bismut, betaina HCL, enzime digestive, antiacide, laxative, ulei mineral, ulei de ricin și/sau argila bentonită
Specimen recoltat – materii fecale.
Recipient de recoltare – 3 recipiente sterile fara mediu de transport. Recipientele se vor primi din centrul de recoltare Synevo în urma programării.
Cauze de respingere a probei – proba contaminata cu apa sau urina sau care nu a fost pastrata la temperatura de 2-8 oC
Stabilitate probă – 6 zile la 2-8o C
Metoda de lucru:
- Metoda imunoenzimatica – EIA
- GC-MS
- Examinare microscopica
- PCR
- Culturile bacteriene și micologice8,9.
Bibliografie:
- Interaction between the gut microbiome and mucosal immune system. Shi N, Li N, Duan X, Niu H. Mil Med Res. 2017 Apr 27;4:14. doi: 10.1186/s40779-017-0122-9. eCollection
- https://atlasbiomed.com/blog/whats-the-difference-between-microbiome-and- microbiota/#microbiome-definition
- The role of the gut microbiome in systemic inflammatory Clemente JC, Manasson J, Scher JU. BMJ. 2018 Jan 8;360: j5145. doi: 10.1136/bmj. j5145.
- Relationships Between Vitamin D, Gut Microbiome, and Systemic Yamamoto EA, Jørgensen TN. Front Immunol. 2020 Jan 21; 10:3141. doi:10.3389/fimmu.2019.03141. eCollection 2019.
- https://enterol.ro/public/docs/Microbiota_brosura_v2.pdf?v=2; Ref Type: Internet Communication.
- Role of the gut microbiota in nutrition and health Ana M Valdes, Jens Walter, Eran Segal, Tim D Spector, BMJ 2018; 361 doi: https://doi.org/10.1136/bmj.k2179
- https://mdpi.com/2076-0817/9/11/944/htm; Ref Type: Internet Communication.
- GI Effects® Stool Profiles | Genova Diagnostics (gdx.net); Ref Type: Internet
- Laborator Synevo. Referinţele specifice tehnologiei de lucru utilizate. 2022. Ref Type:
Produsul a fost adăugat în coș
În plus, ai la dispoziție 30 de zile pentru a veni la recoltare.
