- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Consult genetic
- Genetica medicala
Fenitoin
Preț: 184.00 lei
Informaţii generale şi recomandări pentru testare – Fenitoin
In practica medicală curentă este recunoscută din ce în ce mai mult importanţa determinării periodice a nivelului în sânge al multora din medicamentele administrate, fie datorită potenţialului crescut de reacţii adverse, fie complianţei reduse a pacienţilor.
Monitorizarea terapeutică a unui medicament (Therapeutic Drug Monitoring, TDM) are drept scop menţinerea concentraţiei acestuia în intervalul terapeutic, definit ca acel interval de valori ale nivelului în ser, plasmă sau sânge integral în care medicamentul respectiv îsi exercită efectele clinice cu reacţii adverse minime pentru majoritatea pacienţilor.
Conceptul de TDM se referă astfel la măsurarea concentraţiei medicamentelor pentru a optimiza si adapta tratamentul la nivel individual (terapie personalizată). Pentru realizarea acestei ţinte terapeutice este important să se cunoască pentru medicamentele administrate date legate de:
–farmacocinetică: studiază efectele medicamentului asupra organismului (relaţia doză-efect);
–farmacodinamică: studiază efectele organismului asupra medicamentelor (absorbţie, distribuţie etc);
–farmacogenetică: studiază modelul genetic al metabolizării medicamentelor luând în considerare variaţiile individuale.
Pentru a obţine rezultate pentru concentraţiile medicamentoase cu utilitate clinică este important ca proba să fie recoltată în asa numita „steady state” (stare de echilibru) în care rata de medicament ce pătrunde în organism este egală cu cea eliminată. Atunci când o doză fixă de medicament este administrată la intervale de timp regulate, acesta se va acumula în organism în cursul fazei de absorbţie până este atinsă starea de echilibru; perioada de timp necesară pentru a se ajunge la steady state depinde de timpul de înjumătăţire al medicamentului (T1/2), adică timpul în care concentraţia medicamentului în sânge se reduce la jumătate. La rândul său T1/2 depinde de rata de metabolizare si excreţie. In condiţiile unei distribuţii rapide si uniforme a medicamentului în organism (cinetică de ordinul I), precum si în absenţa unei doze de încărcare, este nevoie de un interval de timp echivalent cu cel puţin 5 T1/2 pentru a obţine steady state (vezi fig. 20.3.1)1;2;4. 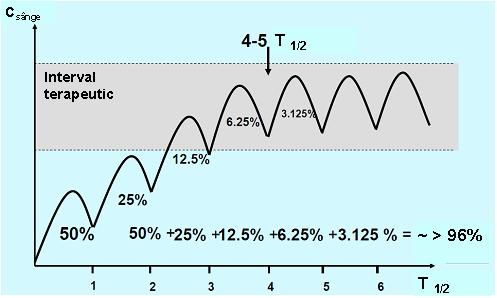
Fig 20.3.1 Obţinerea „steady state”
Acest proces poate fi rezumat astfel:
k k = constanta de dispariţie a lui D
D→E D = concentraţia medicamentului E = forma excretată a medicamentului
T1/2 = 0.693/k
Asa cum reiese din ecuaţie, T1/2 este o constantă si nu depinde de concentraţia medicamentului. Dacă T1/2 este cunoscut se poate calcula modul de împărţire a dozelor si intervalul de timp la care trebuie administrate pentru a se atinge nivelul terapeutic.
Totusi, unele medicamente sunt metabolizate printr-un alt tip de cinetică decât cea de ordinul I, suferind mai întâi o metabolizare în ficat, urmată de o distribuţie multicompartimentală în organism (medicamentul are o anumită rată de distribuţie plasmatică si o rata diferită de distribuţie tisulară). In aceste cazuri timpul necesar pentru a atinge steady state poate să fie diferit de echivalentul a 5 T1/2 .
Cu excepţia urgenţelor medicale, în cazurile în care se modifică dozele administrate si se adaugă sau se scot medicamente asociate, se va astepta obţinerea unei noi stări de echilibru înainte de recoltarea probei pentru monitorizarea terapeutică. Intr-un mod similar, se va astepta aceeasi perioadă de timp până când un medicament aflat în steady state se va elimina din organism la întreruperea administrării2.
Odată atinsă starea de echilibru probele de sânge pot fi recoltate în două momente diferite:
– în momentul nivelului maxim (peak samples): la 2-3 ore după administrarea unei doze orale, la 30-60 minute după o doza administrată intravenos, la 2-4 ore după o doza administrată intramuscular sau la 1-1 si ½ ore după o doză administrată intranazal;
– în momentul nivelului minim (trough samples): imediat înaintea administrării următoarei doze; acest moment este recomandat în majoritatea cazurilor.
Monitorizarea terapeutică a medicamentelor este indicată în special în următoarele situaţii:
Clasele de medicamente pentru care se recomandă în mod special TDM sunt următoarele:
- glicozide cardiace: digoxin, digitoxin;
- antiaritmice: amiodarona, flecainida, procainamida, chinidina;
- antiastmatice: teofilina;
- antibiotice: aminoglicozide, vancomicina;
- antivirale: medicamentele pentru infecţia HIV, ganciclovir;
- anticonvulsivante: fenobarbital, carbamazepin, fenitoin, acid valproic, gabapentin, primidona, lamotrigin;
- medicamente psihotrope: litiu, antidepresive triciclice, neuroleptice;
- imunosupresoare: ciclosporina, tacrolimus, sirolimus, everolimus, acid micofenolic, azatioprina;
- citostatice: methotrexat1;2.
In tabelul de mai jos sunt precizate pentru anumite medicamente T1/2, intervalul de timp necesar pentru a se ajunge la steady state, tipul de probă pentru TDM si stabilitatea acesteia, intervalul terapeutic1;4:
|
MEDICAMENT |
T1/2 |
T până la steady state |
Tip probă |
Stabilitate probă |
Metoda de determinare |
Interval terapeutic |
|
Digoxin |
36-48 h |
7-10 zile |
Ser |
7 zile la 2-8°C |
ECLIA |
0.9-2 ng/mL |
|
Amiodarona |
26-107 zile |
Nu se aplică | Ser |
7 zile la 2-8°C |
HPLC |
0.5-2 mg/L |
| Flecainida |
12-27 ore |
3-6 zile |
Ser |
7 zile la 2-8°C |
HPLC |
0.2-0.8 mg/L |
| Teofilina |
7-11 ore (adult) 1-8 ore (copil) |
15-55 ore (adult);
5-40 ore (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
< 1 an:
5-10 mg/L
≥ 1 an:
8-20 mg/L
|
| Vancomicina |
3-8 ore |
1-2 zile |
Ser |
7 zile la 2-8°C |
FPIA |
5 – 10 µg/mL
|
|
Carbamazepin |
14-47 ore (adult) 8-19 ore (copil) |
7-12 zile (adult); 2-4 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
4-10 mg/L |
|
9-16 ore (adult) 7-13 ore (copil) |
2-4 zile (adult) 2-4 zile (copil) |
Ser | 7 zile la 2-8°C | CEDIA | 50-100 mg/L | |
|
Topiramat |
19-23 ore |
5 zile |
Ser |
7 zile la 2-8°C |
HPLC |
1-10 mg/L |
|
Etosuximid |
50-60 ore (adult) 30 ore (copil) |
8-12 zile (adult) 6-10 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
40-100 mg/L |
|
81-117 ore (adult) 40-70 ore (copil) |
17-24 zile (adult) 8-15 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
10-40 mg/L |
|
|
Fenitoin |
18-22 ore (adult)7-29 ore (copil) |
4-8 zile (adult) 2-5 zile (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
<14 ani:
10-20 mg/L
>14 ani:
6-14 mg/L
|
|
Gabapentin |
5-7 ore (adult) 4-6 ore (copil) |
1-2 zile (adult) 1-2 zile (copil) |
Ser | 7 zile la 2-8°C | HPLC | 2 – 10 µg/mL |
| Lamotrigin |
15-30 ore (adult) 30 ore (copil) |
3-10 zile (adult)
3-10 zile (copil) |
Ser | 7 zile la 2-8°C | HPLC |
<14 ani:
5-15 mg/L
>14 ani:
1-5 mg/L
|
|
Primidona |
3-7 ore (adult) 4-6 ore (copil) |
16-60 ore (adult) 20-30 ore (copil) |
Ser |
7 zile la 2-8°C |
HPLC |
5-15 mg/L |
|
Amitriptilina |
8-51 ore |
2-6 zile | Ser |
7 zile la 2-8°C |
LC-MS/MS | 50-300 µg/L |
|
Litiu |
14-30 ore |
2-7 zile |
Ser |
8 ore la temperatura camerei 24 ore la 2-8°C 6 luni la -18°C |
ISE |
Mania acută: 0.6-1.2 mmol/L. • Protecţie împotriva viitoarelor episoade la pacienţii cu afecţiune bipolară:
0.8-1.0 mmol/L
• Depresie: 0.5- 1.5 mmol/L |
|
Clomipramin |
12-36 ore |
3 săptămâni | Ser |
7 zile la 2-8°C |
LC-MS/MS |
90-250 µg/L |
|
Clozapina |
4-66 ore | Nu se aplică |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
350-600 µg/L |
|
Olanzapin |
21-54 ore (adult ≤65 ani) 32-81 ore (adult >65 ani) |
7 zile |
Ser |
7 zile la 2-8°C | LC-MS/MS | 10-80 µg/L |
|
Doxepin |
8-25 ore |
2.5-5 zile |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
20-150 µg/L |
|
Imipramin |
6-20 ore |
2-5 zile |
Ser |
7 zile la 2-8°C |
LC-MS/MS | 45-150 µg/L |
|
Maprotilin |
36-105 ore |
14 zile |
Ser |
7 zile la 2-8°C | LC-MS/MS | 125-200 µg/L |
|
Trimipramin |
16-39 ore |
Nu se aplică |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
150-350 µg/L |
| Haloperidol |
41-41 ore (lactat) 14-28 zile (decanoat) |
3-9 zile (lactat) nu se aplică |
Ser |
7 zile la 2-8°C | LC-MS/MS | 5-16 µg/L |
|
Risperidon |
3 ore (fast metabolizer risperidon); 21 ore (fast metabolizer9-hidroxi-risperidon); 20 ore (slow metabolizer risperidon); 30 ore (slow metabolizer 9-hidroxi-risperidon); |
1 zi (fast metabolizer risperidon); 5-6 zile (fast metabolizer9-hidroxi-risperidon); 5 zile (slow metabolizer risperidon); nu se aplica (slow metabolizer 9-hidroxi-risperidon). |
Ser |
7 zile la 2-8°C |
LC-MS/MS |
10-120 µg/L |
|
Ciclosporina A |
6-27 ore |
2-6 zile |
Sânge EDTA |
5 zile la -20°C |
LC-MS/MS |
Intervalul terapeutic variază în funcţie de tipul transplantului si perioada de timp de la transplant Pentru afecţiuni dermatologice şi reumatologice:<100 µg/L Pentru sindrom nefrotic:
60-160 µg/L
|
|
Tacrolimus |
4-35 ore (adult) 4-12 ore (copil) |
2-6 zile (adult) nu se aplică la copil |
Sânge EDTA |
5 zile la -20°C |
LC-MS/MS |
– în primele 2 luni de la transplant:
15-20 µg/L
– după 2 luni de la transplant:
8-15 µg/L
|
| Sirolimus |
46-78 ore |
5-7 zile | Sânge EDTA | 5 zile la -20°C | LC-MS/MS | 4-20 µg/L |
|
Acid micofenolic |
8-18 ore (adult)variabil la copil |
Nu se aplică |
Ser |
7 zile la 2-8°C |
HPLC |
1-3.5 µg/mL |
|
Methotrexat |
Cinetică bifazică |
– |
Ser
|
7 zile la 2-8°C protejat de lumină | FPIA | Se asociază cu un risc crescut de toxicitate:
– valorile > 5-10 µmol/L la 24 h de la admistrare; – valorile > 0.5-1 µmol/L la 48 h de la administrare; – valorile > 0.2 µmol/L la 72 h de la administrare |
ECLIA = metodă imunochimică cu detecţie prin chemiluminiscentă
HPLC = cromatografie de lichide sub înaltă presiune
LC-MS/MS = cromatografie de lichide cuplată cu spectrometrie de masă
FPIA = fluorescent polarization immunoassay (metodă imunochimică cu detecţie prin fluorescenţă polarizată)
CEDIA = cloned enzyme donor immunoassay (metodă imunoenzimatică care utilizează tehnologia ADN-ului recombinant)
ISE = ion selective electrode (metodă potenţiometrică)
Anticonvulsivante
Sunt medicamente utile în tratamentul epilepsiei, în special pentru crizele grand mal, petit mal, psihomotorii, precum şi în unele afecţiuni cum ar fi tic douloureux (nevralgia de trigemen). Deşi mecanismul de acţiune al acestor medicamente nu a fost elucidat, se pare că toate, posibil cu excepţia fenobarbitalului, blochează influxul de sodiu în neuronii a căror membrană este afectată. In plus, unele medicamente şi în special fenitoinul blochează de asemenea influxul secundar de calciu în aceste celule. Fenobarbitalul şi, posibil, fenitoinul stabilizează membrana neuronilor afectaţi.
Multe din anticonvulsivante exercită efect asupra convulsiilor grand mal, însă sunt ineficace asupra celor de tip petit mal. Doar etosuximidul şi acidul valproic au un efect terpeutic în aceste condiţii.
In concluzie, deşi mecanismul de acţiune al anticonvulsivantelor pare să fie similar, acestea diferă în ceea ce priveşte specificitatea2.
Fenitoin
Constituie medicamentul de elecţie pentru tratamentul şi profilaxia convulsiilor tonico-clonice şi psihomotorii. Dacă singur nu este eficace se poate asocia cu fenobarbitalul.
Terapia cu fenitoin este iniţiată cu doze de 100-300 mg/zi la adult şi de 4 mg/kg corp/zi la copil. Deoarece absorbţia sa este variabilă şi medicamentul exprimă o cinetică de ordinul 0 (nelineară), dozele trebuie ajustate într-un interval de 5 zile utilizand concentraţia serică pentru ghidarea terapiei. Biodisponibilitatea orala variază între 80% şi 95% fiind dependentă de dietă.
Fenitoinul prezintă de asemenea o farmacocinetică de ordinul 0, adică rata clearance-ului este dependentă de concentraţia medicamentului. Astfel, fenitoinul nu are un timp de înjumătăţire clasic ca celelalte medicamente, deorece acesta variază în funcţie de concentraţia sangvină. La o concentraţie de 15 mg/L aproximativ o jumătate din cantitatea totală de fenitoin din organism va fi eliminată în decurs de 20 ore. Pe măsura ce nivelul sangvin se reduce rata de excreţie a medicamentului creşte.
Fenitoinul are un volum de distribuţie de 0.65 L/kg fiind legat într-o proporţie de 90% de proteinele plasmatice, în special de albumină.
Anumite reacţii adverse ale medicamentului se produc în intervalul terapeutic: hiperplazie gingivala, hiperglicemie, rash.
Farmacocinetică fenitoinului este semnificativ afectată de o serie de medicamente. Asa cum s-a menţionat, fenitoinul se administrează adesea în combinaţie cu fenobarbitalul. Inducţia sistemului enzimatic al citocromului P450 de către fenobarbital va creşte rata de metabolizare a fenitoinului. In steady state inducţia enzimatică va creşte rata de clearance astfel încât, pentru a menţine nivelul terapeutic, este necesar ca doza de fenitoin să fie crescută cu 30%.
Uremia exercită un efect asupra legării fenitoinului de proteinele plasmatice. In faza uremică se acumulează produşii secundari de metabolism care leagă albumina şi deplaseză fenitoinul, ceea ce duce la creşterea fracţiunii libere.
Acidul valproic asociat fenitoinului intră în competiţie cu acesta pentru acelaşi situs de legare de pe albumină. Astfel, acidul valproic deplasează fenitoinul de pe albumină şi conduce la creşterea fracţiunii libere. Efectul global al administrăriii simultane de acid valproic este acela ca nivelul total de fenitoin scade datorită creşterii clearance-ului însă fracţiunea liberă creşte; din acest motiv concentraţia fenitoinei libere, care reprezintă forma activă, rămâne practic aceeaşi, nefiind necesară ajustarea dozelor pentru menţinerea aceluiaşi efect farmacologic.
In insuficienţa renală fracţiunea liberă a fenitoinei nu poate fi usor eliminată, ceea ce conduce la creşterea atât a fracţiunii libere cât şi a nivelului total (fracţiunea liberă creşte însă mai rapid decât concentraţia totală); dozele trebuie reduse pentru evitarea toxicităţii.
Riscul de toxicitate este mare datorita modului particular de metabolizare a fenitoinului. Creşteri mici ale dozelor conduc la creşteri foarte mari ale concentraţiei sangvine, astfel că apar semne precoce ale toxicităţii: nistagmus, ataxie, dizartrie. Toxicitatea severă apare la niveluri >30 mg/L şi se caracterizează prin tremor, hiperreflexie şi letargie. Totuşi, spre deosebire de fenobarbital, consecinţele toxicităţii nu sunt grave, deoarece fenitoinul nu exercită acţiuni deprimante asupra SNC3.
Bibliografie
Produsul a fost adăugat în coș
În plus, ai la dispoziție 30 de zile pentru a veni la recoltare.
