- Teste de hematologie
- Teste de biochimie
- Biochimie generală din sânge și urina
- Proteine specifice in ser si urina
- Teste biochimice din lichide de punctie
- Teste biochimice din materii fecale
- Teste biochimice pentru tulburari ereditare de metabolism
- Teste pentru nefrolitiaza
- Vitamine, oligoelemente, stres oxidativ
- Acizi grași
- Transferina carbohidrat deficitara (CDT) marker pentru alcoolism
- Markeri non-invazivi pentru afecţiunile hepatice
- Analiza chimică calculi
- Markeri endocrini
- Markeri tumorali
- Markeri virali
- Markeri cardiaci
- Markeri anemie
- Markeri ososi
- Markeri boli autoimune
- Anticorpi antispermatozoizi
- Autoanticorpi in afectiuni endocrine, cardiace, renale
- Autoanticorpi in afectiuni neurologice
- Autoanticorpi in afectiunile dermatologice
- Autoanticorpi in anemia pernicioasa
- Autoanticorpi in diabetul zaharat
- Markeri pentru afectiuni hepatice si gastrointestinale autoimune
- Markeri pentru afectiuni reumatismale si vasculite
- Markeri pentru monitorizarea evolutiei si tratamentului
- Markeri pentru sindromul antifosfolipidic
- Serologie boli infectioase
- Teste specializate de alergologie si imunologie
- Teste de biologie moleculara
- Teste de citogenetica
- Teste de microbiologie
- Toxicologie
- Citologie cervico-vaginala
- Histopatologie
- Consult genetic
- Genetica medicala
Sirolimus în sânge
Preț: 225.00 lei
Analiza medicala Sirolimus în sânge se efectuează conform următoarelor specificații/ condiții:
-
- Centrele de recoltare și laboratoarele din București și zonele limitrofe: recoltarea se efectuează de luni până joi, în timpul programului de recoltare;
- Centrele de recoltare și laboratoarele din țară: recoltarea se efectuează de luni până miercuri, în timpul programului de recoltare.
Informaţii generale şi recomandări pentru testare – Sirolimus în sânge
In practica medicală curentă este recunoscută din ce în ce mai mult importanţa determinării periodice a nivelului în sânge al multora din medicamentele administrate, fie datorită potenţialului crescut de reacţii adverse, fie complianţei reduse a pacienţilor.
Monitorizarea terapeutică a unui medicament (Therapeutic Drug Monitoring, TDM) are drept scop menţinerea concentraţiei acestuia în intervalul terapeutic, definit ca acel interval de valori ale nivelului în ser, plasmă sau sânge integral în care medicamentul respectiv îşi exercită efectele clinice cu reacţii adverse minime pentru majoritatea pacienţilor.
Conceptul de TDM se referă astfel la măsurarea concentraţiei medicamentelor pentru a optimiza şi adapta tratamentul la nivel individual (terapie personalizată). Pentru realizarea acestei ţinte terapeutice este important să se cunoască pentru medicamentele administrate date legate de:
– farmacocinetică: studiază efectele medicamentului asupra organismului (relaţia doză-efect);
– farmacodinamică: studiază efectele organismului asupra medicamentelor (absorbţie, distribuţie etc);
– farmacogenetică: studiază modelul genetic al metabolizării medicamentelor luând în considerare variaţiile individuale.
Pentru a obţine rezultate pentru concentraţiile medicamentoase cu utilitate clinică este important ca proba să fie recoltată în aşa numita „steady state” (stare de echilibru) în care rata de medicament ce pătrunde în organism este egală cu cea eliminată. Atunci când o doză fixă de medicament este administrată la intervale de timp regulate, acesta se va acumula în organism în cursul fazei de absorbţie până este atinsă starea de echilibru; perioada de timp necesară pentru a se ajunge la steady state depinde de timpul de înjumătăţire al medicamentului (T1/2), adică timpul în care concentraţia medicamentului în sânge se reduce la jumătate.
La rândul său T1/2 depinde de rata de metabolizare şi excreţie. In condiţiile unei distribuţii rapide şi uniforme a medicamentului în organism (cinetică de ordinul I), precum şi în absenţa unei doze de încărcare, este nevoie de un interval de timp echivalent cu cel puţin 5 T1/2 pentru a obţine steady state (vezi fig. 20.3.1)1;2;4.
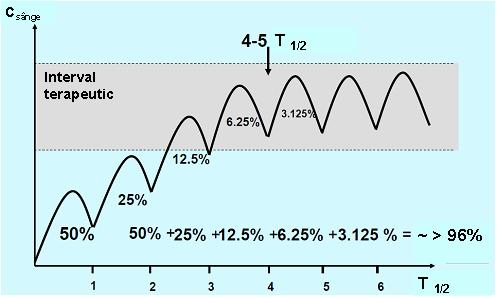
Fig 20.3.1 Obţinerea „steady state”
Acest proces poate fi rezumat astfel:
k k = constanta de dispariţie a lui D
D→E D = concentraţia medicamentului E = forma excretată a medicamentului
T1/2 = 0.693/k
Aşa cum reiese din ecuaţie, T1/2 este o constantă şi nu depinde de concentraţia medicamentului. Daca T1/2 este cunoscut se poate calcula modul de împărţire a dozelor şi intervalul de timp la care trebuie administrate pentru a se atinge nivelul terapeutic.
Totuşi, unele medicamente sunt metabolizate printr-un alt tip de cinetică decat cea de ordinul I, suferind mai întâi o metabolizare în ficat, urmată de o distribuţie multicompartimentală în organism (medicamentul are o anumită rată de distribuţie plasmatică şi o rată diferită de distribuţie tisulară). In aceste cazuri timpul necesar pentru a atinge steady state poate să fie diferit de echivalentul a 5 T1/2 .
Cu excepţia urgenţelor medicale, în cazurile în care se modifică dozele administrate şi se adaugă sau se scot medicamente asociate, se va aştepta obţinerea unei noi stări de echilibru înainte de recoltarea probei pentru monitorizarea terapeutică. Intr-un mod similar, se va aştepta aceeaşi perioadă de timp până când un medicament aflat în steady state se va elimina din organism la întreruperea administrării2.
Odată atinsă starea de echilibru probele de sânge pot fi recoltate în două momente diferite:
– în momentul nivelului maxim (peak samples): la 2-3 ore după administrarea unei doze orale, la 30-60 minute după o doză administrată intravenos, la 2-4 ore după o doză administrată intramuscular sau la 1-1 si ½ ore după o doză administrată intranazal;
– în momentul nivelului minim (trough samples): imediat înaintea administrării următoarei doze; acest moment este recomandat în majoritatea cazurilor.
Monitorizarea terapeutică a medicamentelor este indicată în special în următoarele situaţii:
- perturbarea relaţiei doză-efect;
- eşec în obţinerea efectului terapeutic sau suspectarea unei intoxicaţii;
- efect imposibil sau foarte greu de confirmat clinic (de exemplu în cazul imunosupresoarelor);
- interval terapeutic îngust (de exemplu în cazul glicozidelor);
- complianţă redusă a pacienţilor (persoane vârstnice sau cu boli psihice);
- prezenta unor afecţiuni care afectează absorbţia, distribuţia, metabolizarea şi excreţia medicamentelor;
- administrarea simultana de medicamente care prezintă aceeaşi cale de eliminare;
- copii şi persoane vărstnice la care este afectat volumul de distribuţie: redus în cazul vărstnicilor şi crescut la copii.
Clasele de medicamente pentru care se recomandă în mod special TDM sunt următoarele:
- glicozide cardiace: digoxin, digitoxin;
- antiaritmice: amiodarona, flecainida, procainamida, chinidina;
- antiastmatice: teofilina;
- antibiotice: aminoglicozide, vancomicina;
- antivirale: medicamentele pentru infecţia HIV, ganciclovir;
- anticonvulsivante: fenobarbital, carbamazepin, fenitoin, acid valproic, gabapentin, primidona, lamotrigin;
- medicamente psihotrope: litiu, antidepresive triciclice, neuroleptice;
- imunosupresoare: ciclosporina, tacrolimus, sirolimus, everolimus, acid micofenolic, azatioprina;
- citostatice: methotrexat1;2.
In tabelul de mai jos sunt precizate pentru anumite medicamente T1/2, intervalul de timp necesar pentru a se ajunge la steady state, tipul de probă pentru TDM şi stabilitatea acesteia, intervalul terapeutic1;4:
|
MEDICAMENT |
T1/2 |
T pană la steady state |
Tip probă |
Stabilitate probă |
Metoda de determinare |
Interval terapeutic |
|
Digoxin |
36-48 h |
7-10 zile |
Ser |
7 zile
la 2-8°C
|
ECLIA |
0.9-2 ng/mL |
|
Amiodarona |
26-107 zile |
Nu se aplica |
Ser |
7 zile
la 2-8°C
|
HPLC |
0.5-2 mg/L |
|
Flecainida |
12-27 ore |
3-6 zile |
Ser |
7 zile
la 2-8°C
|
HPLC |
0.2-0.8 mg/L |
|
Teofilina
|
7-11 ore (adult) 1-8 ore (copil)
|
15-55 ore (adult) 5-40 ore (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
< 1 an:
5-10 mg/L
≥ 1 an:
8-20 mg/L
|
|
Vancomicina |
3-8 ore |
1-2 zile |
Ser |
7 zile
la 2-8°C
|
FPIA |
5 – 10 µg/mL
|
|
Carbamazepin |
14-47 ore (adult) 8-19 ore (copil) |
7-12 zile (adult) 2-4 zile (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
4-10 mg/L |
|
Acid valproic |
9-16 ore (adult) 7-13 ore (copil) |
2-4 zile (adult) 2-4 zile (copil) |
Ser |
7 zile
la 2-8°C
|
CEDIA |
50-100 mg/L |
|
Topiramat |
19-23 ore |
5 zile |
Ser |
7 zile
la 2-8°C
|
HPLC |
1-10 mg/L |
|
Etosuximid |
50-60 ore (adult) 30 ore (copil) |
8-12 zile (adult) 6-10 zile (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
40-100 mg/L |
|
Fenobarbital |
81-117 ore (adult) 40-70 ore (copil) |
17-24 zile (adult) 8-15 zile (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
10-40 mg/L |
|
Fenitoin |
18-22 ore (adult) 7-29 ore (copil) |
4-8 zile (adult) 2-5 zile (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
<14 ani:
10-20 mg/L
>14 ani:
6-14 mg/L
|
|
Gabapentin |
5-7 ore (adult) 4-6 ore (copil) |
1-2 zile (adult)
1-2 zile (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
2 – 10 µg/mL |
|
Lamotrigin |
15-30 ore (adult) 30 ore (copil) |
3-10 zile (adult) 3-10 zile (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
<14 ani:
5-15 mg/L
>14 ani:
1-5 mg/L
|
|
Primidona |
3-7 ore (adult) 4-6 ore (copil) |
16-60 ore (adult) 20-30 ore (copil) |
Ser |
7 zile
la 2-8°C
|
HPLC |
5-15 mg/L |
|
Amitriptilina |
8-51 ore |
2-6 zile |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
50-300 µg/L |
|
Litiu |
14-30 ore |
2-7 zile |
Ser |
8 ore la temperatura camerei 24 ore la 2-8°C 6 luni la -18°C |
ISE |
Mania acută: 0.6-1.2 mmol/L • Protecţie împotriva viitoarelor episoade la pacienţii cu afecţiune bipolară:
0.8-1.0 mmol/L
• Depresie:
0.5- 1.5 mmol/L
|
|
Clomipramin |
12-36 ore |
3 saptamani |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
90-250 µg/L |
|
Clozapina |
4-66 ore |
Nu se aplica |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
350-600 µg/L |
|
Olanzapin |
21-54 ore (adult ≤65 ani) 32-81 ore (adult >65 ani) |
7 zile |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
10-80 µg/L |
|
Doxepin |
8-25 ore |
2.5-5 zile |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
20-150 µg/L |
|
Imipramin |
6-20 ore |
2-5 zile |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
45-150 µg/L |
|
Maprotilin |
36-105 ore |
14 zile |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
125-200 µg/L |
|
Trimipramin |
16-39 ore |
Nu se aplica |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
150-350 µg/L |
|
Haloperidol |
41-41 ore (lactat) 14-28 zile (decanoat) |
3-9 zile (lactat) nu se aplica |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
5-16 µg/L |
|
Risperidon |
3 ore (fast metabolizer risperidon) 21 ore (fast metabolizer9-hidroxi-risperidon) 20 ore (slow metabolizer risperidon) 30 ore (slow metabolizer 9-hidroxi-risperidon) |
1 zi (fast metabolizer risperidon) 5-6 zile (fast metabolizer9-hidroxi-risperidon) 5 zile (slow metabolizer risperidon) nu se aplica (slow metabolizer 9-hidroxi-risperidon) |
Ser |
7 zile
la 2-8°C
|
LC-MS/MS |
10-120 µg/L |
|
Ciclosporina A |
6-27 ore |
2-6 zile |
Sânge EDTA |
5 zile
la -20°C
|
LC-MS/MS |
Intervalul terapeutic variază în funcţie de tipul transplantului şi perioada de timp de la transplant Pentru afecţiuni dermatologice şi reumatologice:
<100 µg/L
Pentru sindrom nefrotic:
60-160 µg/L
|
|
Tacrolimus |
4-35 ore (adult) 4-12 ore (copil) |
2-6 zile (adult) nu se aplica la copil |
Sânge EDTA |
5 zile
la -20°C
|
LC-MS/MS |
– în primele 2 luni de la transplant:
15-20 µg/L
– după 2 luni de la transplant:
8-15 µg/L
|
|
Sirolimus |
46-78 ore |
5-7 zile |
Sânge EDTA |
5 zile
la -20°C
|
LC-MS/MS |
4-20 µg/L |
|
Acid micofenolic |
8-18 ore (adult) variabil la copil |
Nu se aplica |
Ser |
7 zile
la 2-8°C
|
HPLC |
1-3.5 µg/mL |
|
Methotrexat |
Cinetica bifazica |
– |
Ser
|
7 zile
la 2-8°C protejat de lumina
|
FPIA |
Se asociază cu un risc crescut de toxicitate: – valorile > 5-10 µmol/L la 24 h de la admistrare – valorile > 0.5-1 µmol/L la 48 h de la administrare – valorile > 0.2 µmol/L la 72 h de la administrare |
ECLIA = metoda imunochimică cu detecţie prin chemiluminiscenţă
HPLC = cromatografie de lichide sub înaltă presiune
LC-MS/MS = cromatografie de lichide cuplată cu spectrometrie de masă
FPIA = fluorescent polarization immunoassay (metoda imunochimică cu detecţie prin fluorescenţă polarizată)
CEDIA = cloned enzyme donor immunoassay (metoda imunoenzimatică care utilizează tehnologia ADN-ului recombinant)
ISE = ion selective electrode (metoda potenţiometrică).
Medicamente imunosupresoare
In timp ce integritatea răspunsului imun umoral şi celular este esenţială pentru prevenirea infecţiilor, în unele situaţii, cum ar fi bolile autoimune şi transplantul de organe solide, devine vital să se suprime activitatea acestor sisteme.
In statusul post-transplant este implicată imunitatea de tip celular. Atât în cazul reacţiilor grefă-contra-gazdă cât şi a celor gazdă-contra-grefă limfocitele T CD4+ sunt activate atunci când un antigen străin se leagă de antigenele HLA clasa a II-a de pe suprafaţa macrofagelor (celulele prezentatoare de antigen). Clonele de celule T specifice se vor lega de antigen prin intermediul receptorului celulei T (TCR); activarea TCR rezultă într-o “cascadă” de transducţie a semnalului care va conduce în final la endocitoza antigenului în macrofage şi distrugerea acestuia în lizozomi.
In această cascadă sunt mobilizaţi ionii de calciu care determină activarea calcineurinei, o fosfatază ce formează un complex cu calmodulinul. Calcineurina activată defosforilează factorul nuclear citosolic al celulelor T activate (NF-AT)C şi astfel îl activează; acesta migrează către nucleu şi se leagă de omologul său (NF-AT)N. Complexul transcripţional activ rezultat va induce sinteza de interleukină-2 (IL-2) care va fi secretată ca un mitogen extracelular.
IL-2 se leagă de receptorul său situat pe limfocitul T, pe care îl activează prin legarea unei proteine, denumită “ţinta rapamicinei” (target of rapamycin = TOR); această proteină activează ciclin-kinazele care facilitează progresia ciclului celular din G1 în S şi stimulează sinteza nucleotidelor. Procesul are ca rezultat diferenţierea şi proliferarea celulelor T şi va conduce în final la distrugerea antigenului.
Au fost dezvoltate medicamente specifice care blochează una sau mai multe din etapele menţionate mai sus, inhibând astfel distrugerea antigenului.
Ciclosporina şi tacrolimusul sunt polipeptide ciclice care se leagă de proteinele intracelulare denumite imunofiline (ciclosporina se leagă de ciclofilină, în timp ce tacrolimusul se leagă de imunofilina denumită FKBP12), rezultând complexe ce blochează ulterior activarea NF-AT indusă de calcineurină şi în consecinţă sinteza de IL-2.
Un alt agent imunosupresor – rapamicina (sirolimus) – nu exercită nici un efect asupra celulelor T, în schimb se leagă de proteina TOR cu rol critic în activarea celulei T.
Micofenolatul mofetil (MMT) este un antibiotic ce este hidrolizat în celule în acid micofenolic liber. Acest agent este un inhibitor potent al inozin-monofosfat dehidrogenazei şi al guanozin-monofosfat sintetazei, împiedicând în final sinteza ADN-ului.
Corticosteroizii exercită de asemenea efecte imunosupresoare asupra imunităţii mediate celular, dar acestea sunt mult mai puţin specifice şi însoţite de numeroase reacţii adverse2.
Sirolimus (Rapamicina)
Este un antibiotic similar tacrolimusului care suprimă proliferarea limfocitelor B si T; de asemenea are activitate antineoplazică şi antifungică.
Inhibă protein kinaza TOR şi blochează astfel ciclul celular. Nu exercită nici un efect asupra calcineurinei şi astfel poate fi utilizat împreună cu ciclosporina şi tacrolimusul.
Sirolimusul este metabolizat de către CYP3A4, astfel că nivelurile sale în sânge sunt afectate atat de medicamentele care inhibă această enzimă cat şi de cele care induc activitatea enzimatică.
Interacţiunea farmacocinetică între sirolimus şi ciclosporina sau tacrolimus creste atât imunosupresia terapeutică cât şi toxicitatea acestor agenţi; ca urmare a folosirii combinate sunt necesare astfel doze mai mici.
Reacţiile adverse sunt în general dependente de doză, de aceea este importantă monitorizarea nivelurilor medicamentului în sânge. Acestea includ tulburări gastrointestinale şi trombocitopenie; medicamentul nu pare să fie nefrotoxic2;4.
Bibliografie
Produsul a fost adăugat în coș
În plus, ai la dispoziție 30 de zile pentru a veni la recoltare.
