Mielom multiplu, o gamapatie monoclonală: mecanisme ale progresiei sale

Mielom multiplu – boala Kahler sau plasmocitomul, este o formă de cancer medular osos, caracterizat prin degenerarea malignă a plasmocitelor.
Grupul patologiilor încadrate în așa-numita gamapatie monoclonală, având o etiologie parțial elucidată, se evidențiază prin proliferarea necontrolată, acumularea de plasmocite (celule cu rol în producerea de anticorpi) și, implicit, sinteza unor gamaglobuline structural omogene (componenta M) sau a unor subunități polipeptidice din compoziția acesteia (lanțuri ușoare de tip kappa și/ sau lamda).
Cuprins:
- Mielom multiplu – prototip al gamapatiilor monoclonale
- MGUS (gamapatie monoclonală de semnificație nedeterminată) și progresia către MM
- Diagnosticul de mielom multiplu
Imunoglobulinele monoclonale secretate de aceste celule servesc ca marker de evidențiere a proliferării, iar cuantificarea acestora poate fi folosită pentru monitorizarea bolii.
Moleculele de imunoglobuline sunt formate din două lanţuri grele identice (α, δ, ε, γ sau μ), care definesc clasa de anticorpi implicați şi două lanţuri uşoare identice (κ sau λ). Fiecare lanţ uşor este legat covalent de câte un lanţ greu, iar cele două lanţuri grele sunt legate covalent între ele, la nivelul unei regiuni numite ”balama”.
În literatura de specialitate, aceste anomalii imunocitare includ: mielomul multiplu, boala Waldenstrom, boala ”lanţurilor grele”, amiloidoza şi o gamapatie monoclonală “benignă” sau gamapatie monoclonală cu semnificaţie nedeterminată.
Mielom multiplu – prototip al gamapatiilor monoclonale
Mielomul multiplu (MM) este o patologie malignă ce constă în proliferarea monoclonală a plasmocitelor, acesta reprezentând un procent de 1% din totalul afecţiunilor maligne şi de 10% din totalul celor de cauză hematologică1.
Clona plasmocitară va produce o imunoglobulină monoclonală, evidenţiată prin intermediul electroforezei proteinelor serice cu imunofixare și/ sau electroforezei proteinelor urinare cu imunofixare – proteina de mielom (M). Aceasta este un „marker tumoral” serologic util în diagnostic şi monitorizare. Proliferarea plasmocitelor, din mielom multiplu poate interfera cu producția normală de celule sanguine, ceea ce va duce la leucopenie, anemie și trombocitopenie.
Etiologia exactă a MM nu a fost încă identificată. Există însă anumiți factori declanșatori, cum ar fi: vârsta mai mare de 65 de ani, sexul masculin, rasa afro-americană, existența unui membru al familiei care suferă de această boală, antecedente personale de gamapatie monoclonală de semnificație nedeterminată (MGUS), obezitatea, expunerea la radiații, contactul cu substanțe chimice utilizate în fabricarea cauciucului, prelucrarea lemnului sau în stingerea incendiilor, inflamația cronică, precum și anumite infecții2.
MM a fost raportat la două sau mai multe rude de gradul I și la gemeni monovitelini, cu toate că nu există dovezi care să sugereze o bază ereditară pentru boală. Un studiu realizat de Clinica Mayo a depistat MM la opt frați, într-un grup de 440 pacienți, la acești frați identificându-se diferite lanțuri grele (lamda), dar același tip de lanțuri ușoare.
MGUS (gamapatie monoclonală de semnificație nedeterminată) și progresia către MM
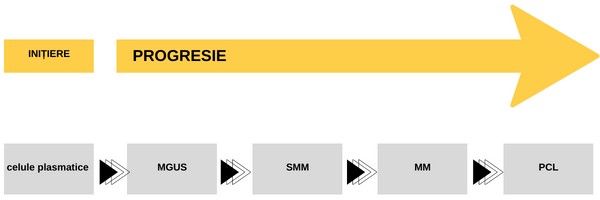
Mielomul multiplu se dezvoltă dintr-o discrazie plasmocidă pre-malignă, și anume din gamapatia monoclonală cu semnificație necunoscută (MGUS).
În timp, MGUS are potențialul de a evolua către mielom multiplu asimptomatic (SMM), care apoi va progresa către MM. Rareori, acesta poate evolua catre leucemie cu celule plasmatice (PCL), o afecțiune în care plasmocitele maligne circulă în sângele periferic, afectarea fiind extramedulară.
Împreună, aceste afecțiuni formează un spectru de tulburări clonale care implică transformarea malignă a plasmocitelor pe termen lung. Cu toate acestea, progresia poate fi foarte lentă și, prin urmare, marea majoritate a pacienților nu progresează trecând prin întregul spectru al bolii.
(Sursa: https://journals.sagepub.com/doi/full/10.1177/1178224219868235)
Un studiu4 efectuat pe o perioadă de 19 ani, în care au fost incluși 42 de pacienți diagnosticați cu Mielom multiplu, a plecat de la presupunerea că progresia cazurilor MGUS cu risc scăzut, atunci când are loc, ar putea fi asociată cu tumori agresive.
Mecanismele biologice pentru această presupusă asociere, sunt neclare. În mod interesant, s-au observat diferențe genomice substanțiale între pacienții cu forme de mielom stabile și progresive, cu modele genomice distincte de progresie („progresie statică” vs. „evoluție spontană”) la pacienții care au progresat de la SMM la MM.
SMM (Mielomul multiplu smelling) este un precursor al MM. Persoanele diagnosticate cu SMM nu necesită tratament imediat, pot fi asimptomatice și este posibil să supraviețuiască mulți ani până ajung să treacă la stadiul 1 de mielom multiplu.
În concordanță cu datele studiului, progresia a fost dificil de prezis la mulți dintre pacienții cu risc scăzut, deoarece, conform studiului amintit 67% au rămas MGUS cu risc scăzut sau mediu la evaluările repetate prin recoltarea probelor de sânge pentru electroforeza proteinelor serice cu imunofixare (evaluări la 7,5 ani după prima probă recoltată). Aceste observații au evidențiat limitările stratificării actuale a MGUS.
Un alt studiu a subliniat că tulburările preexistente ale plasmocitelor, gamapatia monoclonală cu semnificație nedeterminată sau mielomul asimptomatic sunt prezente la cel puțin o treime dintre pacienții cu mielom multiplu.
Cu toate acestea, procentul de pacienți cu o tulburare preexistentă a plasmocitelor nu a fost niciodată determinat prin teste de laborator pe seruri prediagnostice.
Electroforeza proteinelor serice, electroforeza proteinelor serice cu imunofixare și analiza lanțurilor ușoare libere din ser de tip lambda și/ sau kappa, au fost efectuate pe toate serurile colectate, cu doi sau mai mulți ani înainte de diagnosticare pentru a detecta o gamapatie monoclonală. La 30 dintre cei 90 de pacienți, 110 probe prediagnostice au fost disponibile cu 2,2 până la 15,3 ani înainte de diagnostic. O gamapatie monoclonală a fost detectată inițial la 27 dintre cei 30 de pacienți (90%, interval de încredere 95%, 74%-97%); prin electroforeza proteinelor serice și/ sau electroforeza proteinelor serice cu imunofixare la 21 de pacienți (77,8%) și prin analiza lanțurilor ușoare libere serice la 6 pacienți (22,2%).
Patru pacienți au avut o singură probă pozitivă în decurs de 4 ani înainte de diagnosticare, cu toate serurile precedente negative. Toți cei 4 pacienți au evoluat dintr-o formă de gamapatie monoclonală cu lanț ușor. Altfel spus, o formă preexistentă este documentată la majoritatea pacienților cu mielom multiplu, înainte de diagnostic. Unii pacienți progresează rapid de la o fază premalignă5.
Diagnosticul de mielom multiplu
Diagnosticul de MM presupune confirmarea prezenței de plasmocite medulare într-un procent de peste 10% sau confirmarea unui plasmocitom extramedular, şi cel puţin unul dintre următoarele criterii6:
- prezența markerului tumoral plasmocitar medular, reprezentând un procent de peste 60% din totalul plasmocitelor, raport lanțuri libere kappa/lamda serice – raport FLC (free light chain) anormal (≥100-kappa implicat ;< 0.01-lambda implicat)5 și mai mult de o leziune descrisă la rezonanță magnetică (IRM) – (cu dimensiune ≥ 5mm);
- evidenţierea afectării de organ, ce poate fi generată de proliferarea plasmocitară (criteriile CRAB).
Recoltarea de aspirat medular și biopsia sunt esențiale pentru diagnosticul neoplaziei cu plasmocite (NCP). Pe lângă examinarea morfologică, lamele de biopsie trebuie colorate prin tehnica IHC, folosind un anticorp monoclonal (CD138) biomarker specific pentru plasmocite.
Dacă diagnosticul de NCP nu poate fi tranșat pe baza morfologiei celulare și a colorației CD138, se va recomanda testarea prin hibridizare in situ în fluorescență (FISH) pentru evidențierea citoplasmatică de lanțuri ușoare libere de tip kappa și lambda, confirmând astfel prezența plasmocitelor clonale (restricționarea lanțului ușor).
Celulele mielomatoase sunt în mod normal de tip CD138, + CD45 +, CD38 +, CD56 + și CD19 – fiind întâlnite la un procent de 70% dintre pacienți. În gamapatia monoclonală, plasmocitele din măduvă nu exprimă molecula de adeziune a celulelor neurale (CD56), dar celulele mielomului exprimă puternic această proteină de suprafață.
Studiile citogenetice în metafază și analiza FISH interfazică trebuie efectuate în mod obișnuit pentru evaluarea celulelor mielomatoase, pentru studiul prezenței cariotipurilor anormale și al anomaliilor cromozomiale cu caracter prognostic, cum ar fi deleția cromozomului 17, creșterea cromozomului 1q, deleția cromozomului 1p, deleția cromozomului 13 și prezența translocațiilor t (4; 14) sau t (14; 16). Aneuploidia ADN se identifică în măduva hematogenă, la mai mult de 80% dintre pacienți, ceea ce sugerează existența anomaliilor cromozomiale la majoritatea pacienților7.
Testarea de β2-microglobulina serică (β2m) este unul dintre cei mai importanți factori de prognostic în mielom; aceasta este o proteină mică care se asociază cu clasa I a antigenului leucocitar uman și este aproape exclusiv catabolizată în rinichi. β2-Microglobulina este lanțul ușor al moleculelor antigenului uman leucocitar de suprafață (HLA) și este prezentă în concentrații scăzute în serul normal.
Referințe:
- https://srh.org.ro/wp-content/uploads/2020/09/Protocol-Mielom-Multiplu.pdf
- https://www.esmo.org/guidelines/guidelines-by-topic/haematological-malignancies/multiple-myeloma
- https://journals.sagepub.com/doi/full/10.1177/1178224219868235
- https://link.springer.com/article/10.1186/s40164-022-00259-0
- https://ashpublications.org/blood/article/113/22/5418/107738/A-monoclonal-gammopathy-precedes-multiple-myeloma
- https://www.ema.europa.eu/en/documents/product-information/velcade-epar-product-information_ro.pdf
- https://www.mayoclinic.org/diseases-conditions/multiple-myeloma/symptoms-causes/syc-20353378
- https://srh.org.ro/wp-content/uploads/2020/09/Protocol-Mielom-Multiplu.pdf
Produsul a fost adăugat în coș
În plus, ai la dispoziție 30 de zile pentru a veni la recoltare.
